Выделение мезенхимных стромальных клеток пупочного канатика из периваскулярного пространства пупочной вены: оценка функционального состояния клеток и эффективности метода
Для цитирования: Айзенштадт А.А., Багаева В.В., Золина Т.Л., Александрова Л.В., Енукашвили Н.И. Выделение мезенхимных стромальных клеток пупочного канатика из периваскулярного пространства пупочной вены: оценка функционального состояния клеток и эффективности метода. Акушерство и Гинекология Санкт-Петербурга. 2017;(2):36-39.
УДК 618.48 Поступила 25.04.2017
А.А. Айзенштадт 1, 2, В.В. Багаева 2, Т.Л. Золина 2, Л.В. Александрова 2,
Н.И. Енукашвили 2, 3
1СЗГМУ им. И.И. Мечникова, 2 ООО «Покровский Банк стволовых клеток», 3Институт цитологии РАН, Санкт-Петербург, Россия
Мезенхимные стромальные (стволовые) клетки (МСК) – это недифференцированные клетки, происходящие из мезодермального зародышевого листка, обладающие способностью к самоподдержанию популяции и дифференцировке в клетки мезенхимного ряда. В организме МСК отвечают за поддержание гомеостаза и служат для восполнения утраченных элементов кровеносных сосудов и опорно-двигательного аппарата, для заживления ран, для построения сосудистой сети плода и плаценты. С этими свойствами, а также с возможностью культивирования МСК in vitro, связано их интенсивное изучение и применение в качестве основы для клеточной терапии различных заболеваний.
Более чем 30 лет основным источником материала для исследований МСК оставался костный мозг человека и лабораторных животных, но, начиная с конца 90х годов 20 века, клетки с характеристиками, соответствующими МСК, были найдены в большинстве органов млекопитающих. Последнее время все больше внимания исследователей привлекают МСК, выделенные из жировой ткани. Особый интерес представляют утилизируемые ткани, из которых можно получить МСК неинвазивным способом — пульпа молочного зуба, плацента, пуповина, пуповинная кровь, менструальная кровь [1,2,3]. По количеству клеток в пересчете на грамм ткани и с учетом максимально возможного объема получаемой ткани пуповина, пуповинная кровь и плацента представляют собой удобные источники получения МСК. Кроме этого, клетки из этих источников обладают более высоким пролиферативным потенциалом по сравнению с МСК жировой ткани и костного мозга взрослого человека, что позволяет сократить время экспансии, то есть наращивания клеток без утраты диффренцировочного потенциала, в условиях in vitro. и ткани пупочного канатика [4].
В пуповине обнаружено пять зон, из которых возможно выделить МСК — (1) 20-50% свежевыделенной мононуклеарной фракции пуповинной крови, (2) субэндотелиальный слой пупочной вены; (3) внешние слои (периваскулярное пространство) пуповинных сосудов после энзиматической обработки, (4) интраваскулярное пространство (5) субамниотическое пространство (рис. 1). Зоны 3-5 входят в состав Вартонова студня — особого промежуточного материала, состоящего из мукополисахаридов и защищающего пупочные сосуды от перегиба, механических повреждений и других вредных воздействий.

МСК выделенные из разных участков пуповины, гетерогенны по своим свойствам, в частности, по пролиферативной активности и иммунофенотипу [5, 6, 7]. МСК Вартонова студня имеют более низкую пролиферативную активность и не экспресcируют панцитокератин и поверхностный антиген CD146, а МСК первиваскулярного пространства характеризуются высокой скоростью роста популяции in vitro и высоким уровнем экспрессии панцитокератина и CD146 [6]. Кроме того, МСК из этих двух регионов отличаются по уровню продукции IL-6 и Flt3 [7].
Большинство методов получения МСК ПК предполагает измельчение канатика и последующую ферментацию мелких фрагментов [8]. При таком методе, в культуру выводятся МСК из всех пяти зон ПК, что приводит к получению гетерогенной популяции клеток с различными биологическими свойствами. Подобная гетерогенность делает стандартизацию получения МСК ПК трудновыполнимой задачей. Кроме этого, метод измельчения и последующей ферментации требует значительных временных затрат – от 6 до 24 часов. Ранее нами был описан метод получения МСК из периваскулярного пространства методом заполнения пупочной вены раствором коллагеназы и последующей ферментации [9]. В этом методе измельчение канатика и препарирование сосудов заменено на инфузию раствора коллагеназы I в пупочную вену цельного (10-30 см) неизмельченного канатика и последующую инкубацию в течение 30 мин. Однако, недостатками метода являлись сравнительно низкий выход клеток (1 млн на 1 см длины канатика после 1 пассажа) и значительное загрязнение выделяемых клеток другими типами клеток, в-основном, эндотелиоцитами. Данные недостатки не являются препятствием при отсутствии ограничений по времени и значительных требований к количеству материала. Однако эти недостатки делают метод непригодным для клинического использования.
Задачей данной работы являлась разработка метода быстрого (до 3 часов) получения МСК периваскулярного пространства ПК и оценка пролиферативной активности и иммунофенотипа получаемых МСК.
Материалы и методы
Получение МСК ПК.
Фрагменты ПК (10-25 см) получали при наличии информированного согласия представителей ребенка. Забор фрагментов осуществляли после рождения плаценты. Полученные образцы тщательно промывали в физиологическом растворе и помещали в стерильные культуральные флаконы со съемной боковой крышкой (TPP, Швейцария), содержащие раствор антибиотиков и антикоагулянта. Транспортировку из родильных домов Санкт-Петербурга и обработку фрагментов ПК проводили в течение 2-28 часов. До начала обработки образцы сохраняли при комнатной температуре, избегая охлаждения или нагревания. Для выделения клеток промывали пупочную вену последовательно 0,02% Версеном и 0,2% раствором коллагеназ I и IV типа (Sigma-Aldrich, США) в ФСР. После этого один конец пупочного канатика клеммировали и заполняли пупочную вену раствором коллагеназ I, IV, затем клеммировали со второй стороны и инкубировали в течение 20 мин при 37оС (первая ферментация). Затем пупочную вену промывали 2-3 раза ФСР. Полученную взвесь клеток в ФСР центрифугировали (400 G, 10 мин), ресуспендировали в среде ASCM с 10 % заменителя сыворотки (ASCM supplement, Hyclone высевали во флаконы при плотности 100–400 тыс кл/см2. После первой ферментации пупочную вену снова заполняли раствором коллагеназ, как описано выше, и инкубировали в течение 40 мин при 370С (вторая ферментация). После второй ферментации повторяли те же процедуры, что и после первой ферментации. Всего было проанализировано 78 культур МСК, полученных из пупочного канатика.
МСК культивировали при 37оС в атмосфере 5% СО2 и 20% (условия нормоксии) или 5% (условия гипоксии) О2. При достижении 70-80 % конфлюентности монослоя МСК, вне зависимости от источника их получения, пересевали при плотности 1000 кл/см2 и.
2.4. Морфологическая характеристика МСК
Морфологическую характеристику МСК проводили с помощью программы CapturePro v2.8.8. при анализе фотографий случайно выбранных полей зрения, полученных с использованием светового инвертированного микроскопа Axiovert 40C, оснащенного системой анализа изображения Progress CT3 (Zeiss, Германия). Определение среднего размера клеток проводили для МСК, снятых с подложки во время пассирования культуры, с помощью автоматического клеточного счетчика Beckman Coulter (США).
2.5. Определение пролиферативной активности МСК
Количество и жизнеспособность МСК определяли с помощью автоматического клеточного счетчика Beckman Coulter (США). Среднее время удвоения популяции Td расчитывали по формуле Td=(log22)*t/(log2(Nt/N0)), где t – время прироста популяции, Nt – количество клеток через время t, N0 – исходное количество клеток.
Иммунофенотипирование культур МСК
Поверхностные маркеры мезенхимных стволовых клеток выявляли с помощью меченных флуорохромами антител против CD34, CD45, CD90, CD105, CD73, CD13, CD10, CD44, CD14, CD117 на проточном цитофлуориметре FC500 (Beckman Coulter, США) в соответствии с инструкцией производителя. Для этого культуры МСК снимали последовательно 0,02% раствором Версена и 0,25% раствором трипсина. Анализ полученных данных проводили с помощью программного обеспечения СХР.
Статистическая обработка результатов.
Статистическую обработку результатов проводили с использованием программ “Excel” для WinXP и Graph Pad Prism 5.0. В качестве характеристик использовали среднее и стандартное отклонение.
В экспериментах по изучению влияния МСК на аллерген-специфические реакции лейкоцитов оценивали межгрупповые различия с помощьюU критерия Манна-Уитни при выбранном уровне значимости p< 0,05.
Для сравнения результатов сокультивирования были использованы средние значения интенсивности флуоресценции в относительных единицах (Хсредн).
Результаты и обсуждение
Благодаря проведенной нами оптимизации методики выделения клеток из этой ниши возможно получение чистой популяции МСК, лишенной или с минимальной примесью эндотелиоцитов, которые удаляются при первом пассировании.
В предлагаемом методе мы используем аналогичный описанному Айзенштадт и др.(2014) метод заполнения просвета сосудов протеолитическими ферментами без измельчения канатика и/или препарирования сосудов. Однако, для увеличения общего количества клеток и повышения доли МСК в них в методе используется две последовательные обработки канатика смесью коллагеназ I и IV. После первой обработки извлекаются в основном клетки из зон 1-2. Таким образом, эта фракция содержит значительное количество эндотелиоцитов, клеток крови, гематопоэтических стволовых клеток и т.д. После второй обработки в получаемом препарате содержатся преимущественно клетки 3-4 зон, то есть мукополисахариды Вартонова студня (зона 5) в нем чаще всего отсутствуют. В ряде препаратов может обнаруживаться содержимое зоны 5, но это не влияет на степень чистоты клеток, тк фрагменты Вартонова студня удаляются на этапе отмывок. При необходимости обе фракции (после первой и второй обработки коллагеназами) могут быть культивированы (раздельно) на селективных средах с использованием адгезивного пластика. В этом случае, суммарный выход МСК после первого пассажа составлял 3.8*106 млн на 1 см. длины канатика. Причем, в данном случае фракция собранных клеток обогащена быстропролиферирующими МСК периваскулярного пространства и обеднена или лишена медленнорастущих МСК собственно Вартонова студня (зоны 5) (рис. 2).

В среднем, эффективность получения МСК после 1 пассажа составляет 3,1 млн (с минимумом – 0,7 и максимумом – 5,4) на каждые 10 см длины пупочного канатика. Учитывая, что описанные культуры МСК получали из периваскулярного пространства пупочной вены, значимой характеристикой является именно длина образца пупочного канатика, а не его вес. Размер образцов пупочного канатика в среднем составлял 20 см (минимальный размер – 7 см, максимальный – 40 см). Таким образом, после 1 пассажа из одного образца пупочного канатика в среднем можно получить порядка 6 млн МСК. Аналогичное количество МСК можно получить из 50-70 мл костного мозга, либо из 3-5 мл жировой ткани.
Иммунофенотип (набор поверхностных маркеров) выделенных клеток после первого пассирования соответствовал таковому для МСК (табл. 1)
Источник МСК | Пупочный канатик | |
|---|---|---|
Антиген | Гипоксия | Нормоксия |
СD90+ | 99,2 ± 0,5 | 98 ± 0,8 |
CD 105+ | 99,7 ± 0,2 | 99,2 ± 0,4 |
CD 73+ | 99,3 ± 0,7 | 99,4 ± 0,5 |
CD 10+ | 57,8 ± 17,1 | 52,3 ± 16,5 |
CD 13+ | 34,6 ± 14,5 | 39,7 ± 10,9 |
CD 44+ | 99 ± 0,9 | 99 ± 0,6 |
HLA-ABC | 99,5 ± 0,2 | 98,8 ± 1 |
CD 45- | 3 ± 2,4 | 1,7 ± 1,2 |
CD14- | 3,8 ± 3,5 | 3 ± 3,1 |
CD117- | 4,2 ± 3,8 | 5,9 ± 4,6 |
CD34- | 2,1 ± 1,8 | 2,8 ± 2 |
Количество жизнеспособных и пролиферирующих МСК, которые можно выделить из образца пупочного канатика, зависит от величины временного промежутка между родами и началом обработки материала. Если данный интервал составляет менее 7 часов, то среднее количество МСК после 1 пассажа составляет – 3,85 млн на каждые 10 см пупочного канатика. При увеличении временного интервала эффективность выделения МСК значительно снижается (Рис.3).
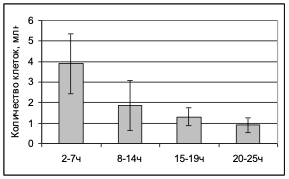
В тоже время количество МСК не зависело от возраста роженицы и срока гестации (37-41 неделя).
Выводы:
- Таким образом, можно говорить о высоком содержании МСК в периваскулярном пространстве пупочного канатика.
- Использование метода двукратной последовательной инфузии раствором коллагеназ позволяет получить культуру МСК периваскулярного пространства, однородную по пролиферативной активности и набору поверхностных маркеров.
- Эффективность получения МСК из пупочного канатика сильно варьирует между образцами, и, в первую очередь, зависит от временного интервала между родами и началом обработки материала.
Литература
- Fukuchi Y., Nakajima H., Sugiyama D., Hirose I., Kitamura T., Tsuji K. Human placenta-derived cells have mesenchymal stem/progenitor cell potential. Stem cells. – 2004; 22(5):649-658. DOI:10.1634/stemcells.22-5-649
- Wang H.S., Hung S.C., Peng S.T., Huang C.C., Wei H.M., Guo Y.J., Fu Y.S., Lai M.C., Chen C.C. Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord. Stem cells. 2004; 22(7):1330-1337. DOI:10.1634/stemcells.2004-0013
- Covas D.T., Panepucci R.A., Fontes A.M., Silva W.A. Jr, Orellana M.D., Freitas M.C., Neder L., Santos A.R., Peres L.C., Jamur M.C., Zago M.A. Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146+ perivascular cells and fibroblasts. Experimental hematology. 2008; 36(5):642-654. doi: 10.1016/j.exphem.2007.12.015.
- Айзенштадт А.А., Енукашвили Н.И., Золина Т.Л., Александрова Л.В., Смолянинов А.Б. Сравнение пролиферативной активности и фенотипа МСК, полученных из костного мозга, жировой ткани и пупочного канатика. Вестник CЗГМУ им. И.И. Мечникова. 2015; 7(2):14-22
- Conconi M.T., Di Liddo R., Tommasini M., Calore C., Parnigotto P.P. Phenotype and differentiation potential of stromal populations obtained from various zones of human umbilical cord: an overview. The Open Tissue Eng Regen Med J. 2011; 4:6-20.
- Carvalho M., Teixeira F.G., Reis R.L., Sousa N., Salgado A.J. Mesenchymal stem cells in the umbilical cord: phenotypic characterization, secretome and applications in central nervous system regenerative medicine. Current stem cell research & therapy. 2011; 6(3): 221-228.
- Xu M., Zhang B., Liu Y., Zhang J., Sheng H., Shi R., Chen H. The immunologic and hematopoietic profiles of mesenchymal stem cells derived from different sections of human umbilical cord. Acta biochimica et biophysica Sinica. 2014; 100.
- Sarugaser R, Lickorish D, Baksh D, Hosseini MM, Davies JE. Human umbilical cord perivascular (HUCPV) cells: a source of mesenchymal progenitors. Stem Cells. 2005; 23(2):220-229. DOI: 10.1634/stemcells.2004-0166
- Айзенштадт А.А., Иванова Н.А., Багаева В.В., Смолянинов А.Б., Самойлович М.П., Климович В.Б. Внутриклеточные иммуноглобулины в линиях Namalva и U266 при сокультивировании с мезенхимными клетками. Цитология. 2014; 56(2):117-121.
Аннотация
Мезенхимные стволовые клетки являются перспективным источником клеток для регенеративной терапии. Возможность их выделения неинвазивными методами из утилизируемых тканей (в том числе из пупочного канатика) является дополнительным достоинством данного клеточного материала. Целью работы являлась разработка метода быстрого (в течение 2-3 часов) получения МСК пупочного канатика из периваскулярного пространства пупочной вены. Разработанный метод двойной ферментации путем двукратной инфузии пупочной вены позволяет выделить МСК, минимизируя времязатраты и повышая однородность выделяемой популяции клеток. Количество клеток при использовании такого метода не зависит от массы канатика, а только от его длины, что делает возможным выделение клеток из тощей пуповины. также не обнаружено зависимости от срока беременности и возраста роженицы. Однако критичным является время от получения фрагмента до начала процедуры выделения клеток. Предполагается, что данный метод может быть использован в клинической практике ввиду чистоты получаемой популяции (следовательно, удобства стандартизации) и небольшого времени проведения процедуры выделения клеток.
Ключевые слова:
пуповина, стволовые клетки, мезенхимные стволовые клетки, культивирование клеток, клеточные культуры
Сведения об авторах.
Айзенштадт Александра Андреевна – к.б.н., научный сотрудник НИЛ клеточных технологий ГБОУ ВПО СЗГМУ им. И.И. Мечникова, Пискаревский проспект д. 47, Санкт-Петербург, 195067, Россия; Научный консультант ООО «Покровский Банк стволовых клеток». Большой проспект В.О. д. 85, Санкт-Петербург, 199106, Россия
Багаева Варвара Владимировна – научный сотрудник отдела научных исследований и разработок ООО «Покровский Банк стволовых клеток». Большой проспект В.О. д. 85, Санкт-Петербург, 199106, Россия
Золина Татьяна Леонидовна – руководитель отдела контроля качества ООО «Покровский Банк стволовых клеток». Большой проспект В.О. д. 85, Санкт-Петербург, 199106, Россия
Александрова Людмила Владимировна – зав. лабораторией клеточных культур ООО «Покровский Банк стволовых клеток». Большой проспект В.О. д. 85, Санкт-Петербург, 199106, Россия
Енукашвили Натэлла Иосифовна – к.б.н., руководитель отдела научных исследований и разработок ООО «Покровский Банк стволовых клеток». Большой проспект В.О. д. 85, Санкт-Петербург, 199106, Россия; Старший научный сотрудник лаб. морфологии клетки Института цитологии РАН. Тихорецкий пр. 4, Санкт-Петербург, 194064, Россия
Для контактов
Енукашвили Натэлла Иосифовна, nie@newmail.ru
Как цитировать:
Айзенштадт А.А., Багаева В.В., Золина Т.Л., Александрова Л.В., Енукашвили Н.И. Выделение мезенхимных стромальных клеток пупочного канатика из периваскулярного пространства пупочной вены: оценка функционального состояния клеток и эффективности метода. Акушерство и гинекология Санкт-Петербурга. 2017; (2):
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов
Received 25.04.2017
A new method of mesenchymal stem cell isolation from umbilical cord vein perivascular area: analysis of cells functional state and the method efficiency
A.A. Aisenshtadt1,2, V.V. Bagaeva2, T.L. Zolina 2, L.V. Alexandrova2, N.I. Enukashvili 2,3
1North-Western State Medical University named after I.I. Mechnikov, 2 LLC «Pokrovsky Bank of stem cells», 3Institute of Cytology, St. Petersburg, Russia
Abstract
Aim: The work was aimed on establishing a new method of mesenchymal stem cells isolation from umbilical cord vein perivascular area. The method should allow fast (less than 3 hrs) and reliable isolation of cells.
Materials and methods. The umbilical cord fragments were obtained from healthy donors after informed consents were signed by their parents. The method of double fermentation was developed in the current work. The umbilical cord vein lumen was perfused by washing solution (Versene), clamped at one side, filled with collagenases for 20–40 min and then washed again with PBS. Then lumen was filled with collagenases again and incubated for another 30–60 min. Both fractions were cultured and analysed for their morphology, cells and immunophenotype.
Results. The method of double fermentation allowed to shorten the time of umbilical cord processing and to increase the population homogenicity. The cells yield depended not on the umbilical cord weight but on its length. Thus the method is suitable for thin umbilical cords. The cells yield did not depend on the mother age or gestational age. The length of period between birth and cord processing is critical in this method – it should not exceed 12 hrs. Предполагается, что данный метод может быть использован в клинической практике ввиду чистоты получаемой популяции (следовательно, удобства стандартизации) и небольшого времени проведения процедуры выделения клеток.
Conclusion. The method can be used both in laboratory and in manufacturing process due to its stability and low time-consuming.
Key words: umbilical cord, stem cells, mesenchymal stem cells, cell cultures.
Aim
Materials and methods:
Results:
Conclusion:
Key words:
References
- Fukuchi Y., Nakajima H., Sugiyama D., Hirose I., Kitamura T., Tsuji K. Human placenta-derived cells have mesenchymal stem/progenitor cell potential. Stem cells. – 2004; 22(5):649-658. DOI:10.1634/stemcells.22-5-649
- Wang H.S., Hung S.C., Peng S.T., Huang C.C., Wei H.M., Guo Y.J., Fu Y.S., Lai M.C., Chen C.C. Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord. Stem cells. 2004; 22(7):1330-1337. DOI:10.1634/stemcells.2004-0013
- Covas D.T., Panepucci R.A., Fontes A.M., Silva W.A. Jr, Orellana M.D., Freitas M.C., Neder L., Santos A.R., Peres L.C., Jamur M.C., Zago M.A. Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146+ perivascular cells and fibroblasts. Experimental hematology. 2008; 36(5):642-654. doi: 10.1016/j.exphem.2007.12.015.
- Aiasenshtadt A.A., Enukashvili N.I., Zolina T.L., Aleksandrova L.V., Smolyaninov A.B. Comparison of proliferative activity and phenotype of MSC obtained from bone marrow, adipose tissue and umbilical cord. Vestnik CZGMU im. I.I. Mechnikova. 2015; 7 (2): 14-22Conconi M.T., Di Liddo R., Tommasini M., Calore C., Parnigotto P.P. Phenotype and differentiation potential of stromal populations obtained from various zones of human umbilical cord: an overview. The Open Tissue Eng Regen Med J. 2011; 4:6-20.
- Carvalho M., Teixeira F.G., Reis R.L., Sousa N., Salgado A.J. Mesenchymal stem cells in the umbilical cord: phenotypic characterization, secretome and applications in central nervous system regenerative medicine. Current stem cell research & therapy. 2011; 6(3): 221-228.
- Xu M., Zhang B., Liu Y., Zhang J., Sheng H., Shi R., Chen H. The immunologic and hematopoietic profiles of mesenchymal stem cells derived from different sections of human umbilical cord. Acta biochimica et biophysica Sinica. 2014; 100.
- Sarugaser R, Lickorish D, Baksh D, Hosseini MM, Davies JE. Human umbilical cord perivascular (HUCPV) cells: a source of mesenchymal progenitors. Stem Cells. 2005; 23(2):220-229. DOI: 10.1634/stemcells.2004-0166
- Aisenshtadt A.A., Ivanova N.A., Bagayeva V.V., Smolyaninov A.B., Samoylovich M.P., Klimovich V.B. Intracellular immunoglobulins in the lines of Namalva and U266 when co-cultivated with mesenchymal cells. Tsitologiya. 2014; 56(2):117-121.
Authors:
Aisenshtadt Alexandra A., PhD, Researcher of the Research Laboratory of Cell Technologies of North-Western State Medical University named after I.I. Mechnikov, 47 Piskarevskiy prospect, St. Petersburg, 195067, Russia; Scientific adviser in LLC «Pokrovsky Bank of stem cells», 85 Bolshoy Prospect, V.O. St. Petersburg, 199106, Russia
Bagaeva Varvara V., Researcher of the Department of Scientific Research and Development in LLC «Pokrovsky Bank of stem cells», 85 Bolshoy Prospect, V.O. St. Petersburg, 199106, Russia
Zolina Tatiana L., Head of Quality Control Department Development in LLC «Pokrovsky Bank of stem cells», 85 Bolshoy Prospect, V.O. St. Petersburg, 199106, Russia
Alexandrova Ludmila V., Head of Cell Culture Laboratory in LLC «Pokrovsky Bank of stem cells», 85 Bolshoy Prospect, V.O. St. Petersburg, 199106, Russia
Enukashvili Natella I., PhD, Head of Research and Development Department in LLC «Pokrovsky Bank of stem cells», 85 Bolshoy Prospect, V.O. St. Petersburg, 199106, Russia; Senior Researcher Laboratory Morphology of the Cell of the Institute of Cytology RAS. 4 Tikhoretsky pr., St. Petersburg, 194064, Russia.
Corresponding author:
Enukashvili Natella I., e-mail: nie@newmail.ru
Suggested citation for this article:
Aisenshtadt A.A., Bagaeva V.V., Zolina T.L., Alexandrova L.V., Enukashvili N.I.
A new method of mesenchymal stem cell isolation from umbilical cord vein perivascular area:
analysis of cells functional state and the method efficiency. Akusherstvo i ginekologia Sankt-Peterburga. 2017; (2):
Conflicts of Interest:
The authors declare no conflict of interest.

