Клеточные технологии в терапии хронической ишемии
ВАЖНО! Данная информация предназначена для специалистов в области здравоохранения
Биотехнологический центр
Клеточная терапия хронической ишемии нижних конечностей
Клиническая картина хронической ишемии нижних конечностей может быть обусловлена как изолированными, так и сочетанными окклюзиями брюшной аорты, ее бифуркации, подвздошных и бедренных артерий, а так же артерий голени и стопы. Основными морфологическими проявлениями хронической ишемии нижних конечностей являются облитерирующий атеросклероз, эндартериит и тромбангиит (болезнь Бюргера). В терминальной стадии этих заболеваний развивается состояние известное как «критическая ишемия нижних конечностей» (КИНК) [1]. Согласно определению Российского консенсуса по диагностике и лечению пациентов с критической ишемией, European Consensus и Trans Atlantic Inter-Society Consensus (TASC), основными клиническими признаками КИНК являются: наличие хронической артериальной недостаточности нижних конечностей, постоянная боль в покое, требующая обезболивания в течение 2 недель и более, трофическая язва или гангрена пальцев или стопы [2, 3, 4].
КИНК соответствует III Б и IV стадиям ишемии по классификации Покровского-Фонтейна [4]. Основными факторами риска развития обструктивного поражения периферических сосудов являются: курение, сахарный диабет, гиперхолестеринемия, артериальная гипертензия [4, 5, 6].
По результатам национального исследования проведенного Ангиологическим Советом Великобритании (1996-2006), частота КИНК составляет 400 больных на 1 млн. населения в год [7]. Если учесть, что 3 % населения страдают перемежающейся хромотой и у 5 % из них в течение 5 лет может развиться КИНК, то частота равна 300 случаев на 1 млн. населения в год. Около 90 % всех ампутаций выполняются по поводу выраженной ишемии нижних конечностей. Пациентам с КИНК у 25 % проводится ампутация конечности на уровне голени или бедра [6].
Наравне с характерными клиническими проявлениями хронической артериальной недостаточности нижних конечностей (боль в покое, «перемежающая хромота», бледность и похолодание кожных покровов, трофические нарушения), существуют инструментальные методы диагностики, позволяющие объективно оценить уровень дефицита артериального кровотока. Первостепенным и наиболее важным показателем, объективно оценивающим состояние гемодинамики при КИНК, является лодыжечно-плечевой индекс (ЛПИ). Нормальными считаются значения ЛПИ выше 0,9. При КИНК лодыжечное давление < 50 мм.рт.ст., пальцевое давление < 30-50 мм.рт.ст., ЛПИ < 0,4 [7].
Несмотря на простоту в диагностике КИНК, лечение этого состояния зачастую сопровождается определенными трудностями. Популяция больных с высоким риском сердечно-сосудистых заболеваний это, как правило, пожилые и ослабленные люди. У пациентов с сахарным диабетом, КИНК наблюдается примерно в пять раз чаще, а трофические нарушения развиваются у 10 % пациентов [11].
Во всех случаях, основной целью лечения КИНК является реваскуляризация тканей. Она может быть достигнута путем формирования шунта «в обход» места окклюзии сосуда, либо ангиопластикой (тромбэндартерэктомия, стентирование и баллонная дилатация просвета сосуда, лазерная абляция атеросклеротических бляшек и др.) [3, 9, 10, 11]. Анализ данных полученных после шунтирующих операций и чрескожной транслюминальной ангиопластики не выявил значимых различий в летальности [12].
Летальность после реконструктивных операций составляет 2-13 %, а частота ампутаций до 10 %. В сроки до 10 лет проходимость сосудистых протезов сохраняется в аорто-подвздошном сегменте у 80-90 % пациентов. Результаты внеполостных операций хуже: через 3 года проходимы 60-70 % бедренно-бедренных шунтов и 64 % подмышечно-бедренных шунтов [13]. По данным Согласительного документа Российского общества сердечно-сосудистых хирургов, при КИНК через 1 год после бедренно-подколенного шунтирования аутологичной веной сохраняется проходимость 75 % шунтов, протезом – 65 %. После бедренно-тибиального шунтирования аутологичной веной сохраняется проходимость 70 % шунтов и 40 % протезов. Результаты ангиопластики показывают, что через 2 года проходимы 85 % подвздошных артерий и лишь 50 % бедренных и подколенных артерий.
Ситуация осложняется еще и тем, что КИНК в большинстве случаев обусловлена тяжелым и диффузным поражением периферических артерий конечности, часто сочетающимся с выраженным дефицитом кровотока на уровне микроциркуляторного русла. В условиях поражения дистального сегмента конечности и микроангиопатии, а так же при неэффективности ранее проведенной реваскуляризации, медикаментозное лечение остается единственным доступным вариантом лечения до ампутации. У пациентов с КИНК при отсутствии условий для «прямой» реваскуляризации, стандартная консервативная терапия малоэффективна. В ближайшие сроки от начала лечения, положительный результат отмечается лишь у половины пациентов, а 1/3 пациентов являются кандидатами на ампутацию.
Однолетняя выживаемость больных перенесших ампутацию на уровне голени составляет около 30 %. Смертность остается главной проблемой в этой популяции пациентов, 30-40 % из них живут менее 5 лет, а при КИНК сочетающейся с язвами или гангреной процент летальности еще выше [9]. По данным TASC, среди пациентов с КИНК от 10 до 30 % живут не более 6 месяцев, и 25-30 % пациентов может потребоваться «массивная» ампутация [3]. Прогноз после ампутации так же не утешителен: ранняя послеоперационная летальность составляет около 5-10 % после ампутации на уровне голени, и 15-20 % после ампутации на уровне бедра. Из пациентов перенесших операцию, около 30 % умирают в ближайшие 2 года. Повторная ампутация требуется у 1/3 больных. Притом, что полная реабилитация может быть достигнута менее чем у половины из них [2, 14].
Большое внимание в настоящее время уделяется определению места непрямых методов реваскуляризации в лечении КИНК. Наиболее часто используемыми операциями являются поясничная симпатэктомия (ПСЭ) и реваскуляризирующая остеотрепанация. В качестве самостоятельных методов лечения они используются только при невозможности выполнения прямых реконструктивных вмешательств. В ближайший послеоперационный период ПСЭ эффективная у 45 % пациентов, а спустя 4 года она позволяет сохранить конечность лишь у 35 % пациентов. Положительный эффект при проведении остеотрепанации наблюдается в 28 % случаев, при 50 % сохраненных конечностей спустя 4 года. Несколько лучшие результаты наблюдаются при сочетании обеих методик, спустя 4 года удается сохранить конечность более чем у 60 % пациентов [15]. Сочетание методов непрямой реваскуляризации с реконструктивными операциями (особенно в случае повторного их выполнения) также дает хороший терапевтический эффект [16]. Продолжается поиск альтернативных путей реваскуляризации ишемизированных тканей. Одним из путей стимуляции неоангиогенеза может быть применение клеточных и генных технологий [16].
Биологические и патофизиологические основы клеточной терапии критической ишемии нижних конечностей
В последнее время были проведены исследования, которые показали, что образование кровеносных сосудов в постнатальном периоде обусловлено наличием клеток-предшественников эндотелиальных клеток (ЭК) в стенках сосудов [7]. Однако есть все основания полагать, что эти клетки-предшественники могут сохраняться на протяжении всей жизни организма и принимать участие в обновлении сосудов [17-19].
Формирование новых сосудов – неоангиогенез, во взрослом организме рассматривается как результат пролиферации, миграции и ремоделирования уже имеющихся зрелых ЭК [20]. В неоваскуляризации участвуют предшественники эндотелиоцитов (ПЭ) CD34+ фракции стволовых клеток периферической крови взрослых, после их мобилизации из костного мозга (КМ) [7, 19, 21, 22] (рис. 1).
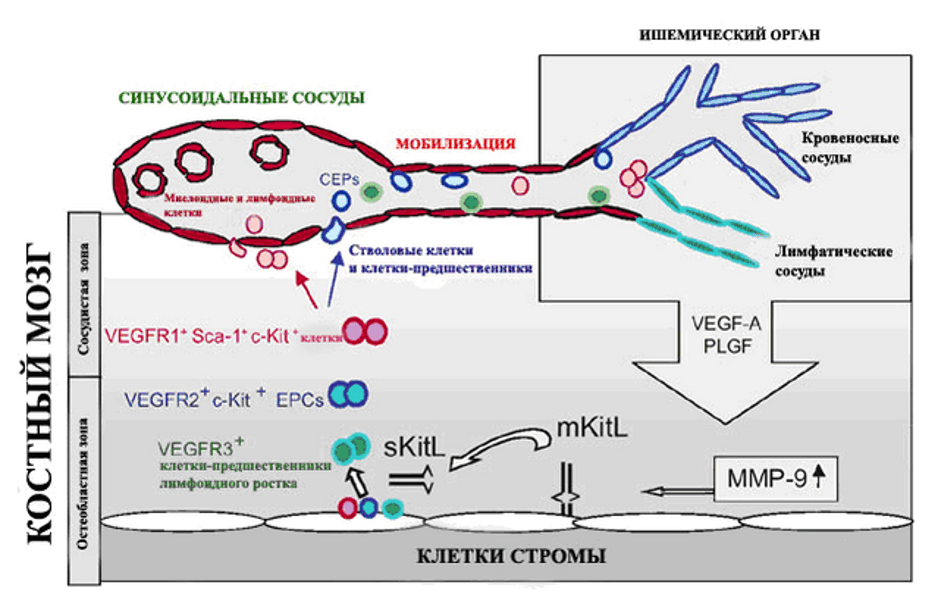
В этом контексте, терапевтический неоангиогенез представляется важной стратегией спасения тканей при КИНК [23-26]. Быстрая реваскуляризация в поврежденных (ишемизированных) и в регенерирующих органах чрезвычайно важна для восстановления функций. Сосудистая травма или ишемия тканей активирует каскад молекулярно-генетических реакций, главным результатом которых, является мобилизация из КМ и других источников, предшественников эндотелиальных клеток обеспечивающих реваскуляризацию за счет образования новых сосудистых формаций [25-31]. Проведенные исследования показали, что клетки КМ участвуют в неоангиогенезе при заживлении ран [31-41] и ишемии нижних конечностей [31, 32], эндотелизации сосудистых протезов [42-45], при атеросклерозе [7, 46], васкуляризации в период постнатального роста [47] и при опухолевом росте [33, 48-52].
Эти исследования свидетельствуют, что во время повреждения сосудов или регенерации органа, происходит высвобождение цитокинов, которые опосредуют миграцию ПЭ и циркулирующих эндотелиальных клеток (ЦЭК) в зону неоангиогенеза. Например, тканевая ишемия приводит к включению сосудистых факторов, таких как: сосудистый эндотелиальный фактор роста (VEGF), который связываясь с рецепторами (VEGF-R2 и VEGF-R1) клеток участвующих в неоангиогенезе, обеспечивает миграцию последних в зону повреждения. Быстрое внедрение клеток в зону неоангиогенеза ускоряет восстановление сосудов, позволяет избежать потенциальных сосудистых осложнений: вторичного тромбоза и гипоксии. В настоящее время, активно разрабатываются технологии получения сосудистых факторов, которые способны ускорять процессы реваскуляризации тканей [52-59]. Патологические изменения в сосудах и тканях, в большинстве случаев, обусловлены недостаточным количеством в зоне повреждения резервных ЭК, которые в норме способны самостоятельно восстанавливать васкуляризацию (рис.1). Таким образом, появилась потребность в дополнительных факторах, способных восстановить васкуляризацию. На роль одного из таких факторов могут претендовать ПЭ.
Исследования последних лет доказали, что в КМ находятся сосудистые прогениторные клетки, которые могут поступать в зону ишемии и принимать участие в процессах реваскуляризации [5].
Участие клеток костного мозга в атеросклерозе и артериосклерозе
Патологическая пролиферация гладкомышечных клеток (ГМК) приводит к изменениям интимы существующей до формирования атероматозной бляшки, рестеноза после ангиопластики и трансплантация — зависимой васкулопатии (рис.2).
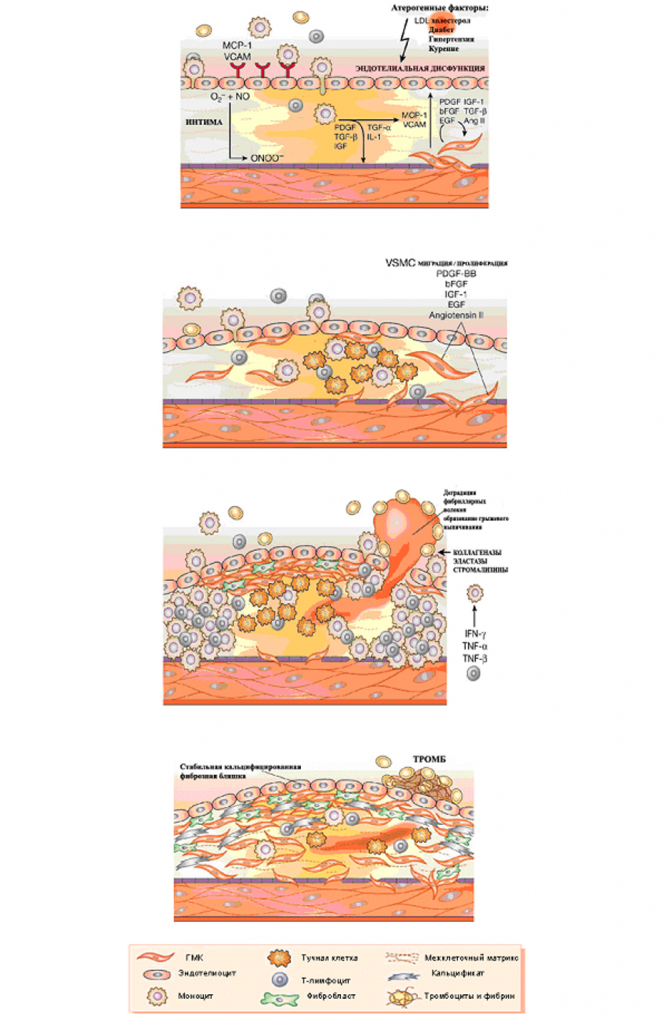
Опыты на животных доказали, что гемопоэтические клетки фенотипа Sca1+cKit+Lin- дифференцируются в ГМК и участвуют в рестенозе после ангиопластики, васкулопатии протеза и атеросклерозе [85]. Механическое повреждение бедренной артерии так же приводит к мобилизации клеток костного мозга отвечающих за пролиферацию ГМК. Получены доказательства участия клеток КМ в образовании атероматозных бляшек в сосудах человека[86].
Рекрутинг ЭК и ГМК из костного мозга, либо из донорского трансплантата зависит от основной имеющейся патологии. На моделях атеросклеротического поражения сосудистого протеза, большинство ЭК и ГМК были выделены из сосудов хозяина, с минимальным участием прогениторов КМ [88]. Однако степень участия клеток КМ может вирировать в зависимости от тяжести сосудистой травмы [93]. Механическая травма сосуда приводит к глубокому проникновению клеток КМ в поврежденную интиму. Каждый инсульт приводит к высвобождению специфических факторов, которые способствуют гиперплазии интимы, это возможно при тяжелой сосудистой травме и в случае иммуноопосредованной трансплантационной васкулопатии [87], приводящей к высвобождению цитокинов которые индуцируют мобилизацию клеток КМ. Были изучены возможности клеток линии Sca1+cKit+Lin- дифференцироваться в разные ткани, включая ЭК и ГМК [89, 94, 95]. Однако, для подтверждения участия клеток КМ в образовании функционально полноценных артерий необходимо проведение дополнительных исследований.
Роль предшественников эндотелиоцитов в васкуляризации тканей
Обновление сосудов происходит посредством мобилизации ПЭ и ЦПЭ. Исследованиями, выполненные молекулярно-генетическими методами доказали возможность поступления ПЭ КМ в ишемизированные конечности мышей [19, 39, 66]. Другие исследования показали, что трансплантация зрелых эндотелиоцитов полученных при культивировании in-vitro мультипотентных предшественников стволовых клеток взрослого организма выделенных из костного мозга, значительно ускоряет процессы реваскуляризации тканях [22, 67]. Заслуживает внимание экспериментальная работа по замещению у взрослой собаки грудного отдела аорты дакроновым протезом, перед протезированием собаке выполнялась пересадки аллогенного костного мозга. Через 3 месяца, в протезе определялся рост эндотелиальных клеток [43, 66].
Уменьшение содержания ЦЭК в кровотоке коррелирует с высоким уровнем сердечно-сосудистых осложнений [87]. J. M. Hill et al. (2003) предположили что, снижение уровня ЦЭК ухудшает восстановление поврежденных сосудов. Однако, патофизиологическая роль ЦЭК КМ до сих пор не определена.
Трансплантация клеток костного мозга в лечении критической ишемии нижних конечностей
В экспериментальных моделях КИНК для неоангиогенеза были использованы различные типы клеток. Исследования показали, что в ангиогенезе могут участвовать: мононуклеарные клетки (МНК) КМ [58, 63] и гемопоэтические стволовые клетки (ГСК) [72, 73, 74], мобилизованные эндотелиальные прогениторные клетки [19, 39, 77], клетки стромы костного мозга [75], стволовые клетки, выделенные из жировой ткани [76].
В доклинических исследованиях, введение предшественников эндотелиоцитов эффективно ускоряло формирование коллатеральных сосудов, минимизируя при этом зону ишемического повреждения [58, 60, 63]. Механизмы участия ПЭ в васкуляризации тканей человека окончательно не изучены. Основная причина – трудности в выделении и распознавании ПЭ и ЦЭК вследствие отсутствия специфических эндотелиальных маркеров и невозможности отличить эти клетки от зрелых эндотелиоцитов сосудистой стенки. Более того, подгруппа миело-моноцитарных клеток может быть неправильно интерпретирована как ПЭ или ЦЭК, поскольку они тоже экспрессируют эндотелий-специфические антигены [90, 91].
ПЭ выделенные из костного мозга, ЦЭК и зрелые эндотелиоциты выделенные из сосудистой стенки экспрессируют схожие эндотелий-специпифичные маркеры включая VEGF-R2, Tie-2, сосудистый эндотелиальный кадгерин (VE-cadgerin), CD34+, CD146+ и E-селектин [19, 39, 41, 91, 92]. Различие между ПЭ, ЦЭК и ЭК так же осложняется тем, что ГСК экспрессируют маркеры сходные с теми, которые экспрессируют ЭК, включая CD34+, PECAM (CD31+), Tie-2, фактор Виллебранда и VEGF-R1.
Проведенные клинические исследования определили высокий потенциал клеток КМ в восстановлении васкуляризации ишемизированных тканей (рис. 3, рис. 4) [33, 59, 61, 62, 63, 81].
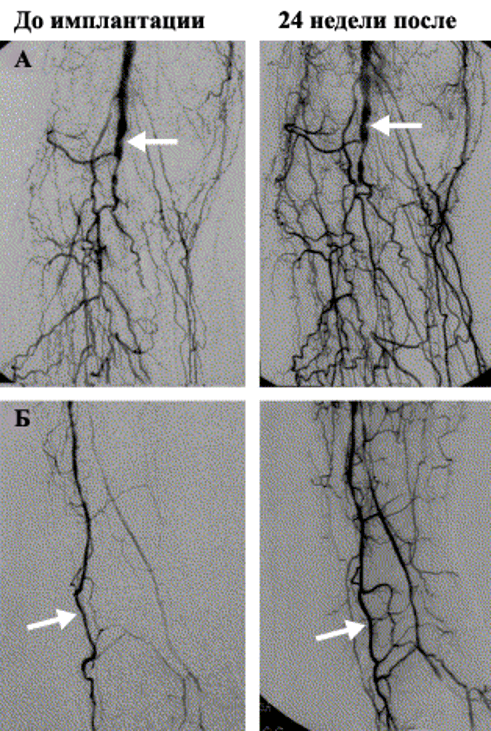
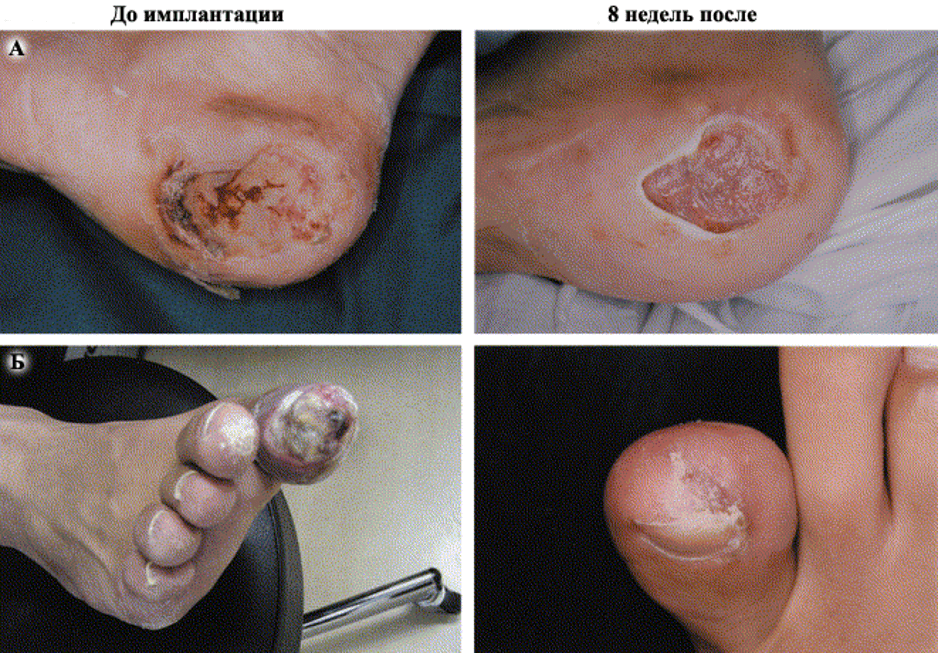
Успех этой стратегии зависит от определения механизмов, посредством которых стволовые и прогениторные клетки проходят молекулярные перестройки необходимые для их направленной пролиферации, мобилизации и дифференцировки и тем самым, определяется их функциональное поведение в тканях взрослого организма.
Первое клиническое исследование по применению стволовых клеток в лечении КИНК опубликовано в 2002 г. Е. Tateishi-Yuyama et al., которые исследовали эффективность и безопасность имплантации аутологичных МНК из КМ больным с КИНК [67]. Под общей анестезией они аспирировали 500,0 мл КМ из гребня подвздошной кости. Через 3 часа после аспирации, фракция изолированных МНК была введена в икроножные мышцы посредством 40 инъекций по 0,75 мл каждая инъекция. Количество введенных клеток составило 0,7-2,8 × 109. Пациентов разделили на 2 группы, в первой – вводили МНК выделенные из КМ, во второй – в мышцы одной конечности МНК выделенные из КМ, в мышцы другой конечности ГСК после стимуляции G-CSF. Результатом лечения через 4 недели, было появление коллатералей, повышение чрезкожного напряжения кислорода, уменьшение болей и времени ходьбы до появления болей. Во второй группе значительное улучшение перечисленных параметров было на стороне введения МНК КМ. Осложнений связанных с проведенным лечением отмечено не было. Исследование показало, что трансплантация аутологичных МНК КМ является безопасной и эффективной процедурой для проведения терапевтического ангиогенеза.
В двух других исследованиях пациентам с КИНК производилась трансплантация предшественников ЭК в сочетании с введением сосудистых факторов роста получен стойкий эффект спустя 6 месяцев с момента трансплантации. Авторы так же указывают на безопасность и эффективность методики [68, 69]. Аналогичное по методике исследование проведено группой под руководством К. Esato. Ими проведена трансплантация МНК выделенных из костного мозга 8 больных с хроническими обструктивными заболеваниями артерий нижних конечностей осложненных образованием трофических язв [77]. В сроки до 6 месяцев от начала терапии, наравне с клиническим улучшением и исчезновением большинства симптомов, отмечено заживление язв.
Р.Р. Huang et al. (2004) предложили другой подход к аутологичной трансплантации МНК мобилизованных в периферическую кровь посредством G-CSF. В исследовании приняли участие 5 человек страдающих облитерирующим атеросклерозом нижних конечностей III и IV степени. Все пациенты имели трофические нарушения в виде язв или гангрены. Этим пациентам в течение 5 дней подкожно вводили G-CSF в дозе 600 μ/сут [78]. Для снижения потенциального риска артериального тромбоза на фоне введения G-CSF, пациентам вводили гепарин в дозе 10000 ЕД/сут. Стимуляция G-CSF позволила увеличить содержание CD34+ клеток в периферической крови в 100 раз. После стимуляции из периферической крови пациентов была получена суспензия 300 мл, содержащая фракцию МНК обогащенную CD34+. Методика введения МНК, аналогична описанной ранее. Через 3 месяца наблюдений основные клинические симптомы значительно улучшились более чем у половины больных. При ангиографии отмечалось существенное улучшение коллатерального кровотока.
- Van Royen et al. (2003) было проведено пилотное исследование, которое заключалось в проведении монотерапии G-CSF у пациентов с облитерирующими заболеваниями артерий нижних конечностей. Были получены хорошие результаты, дающие место данному методу лечения среди других методов непрямой реваскуляризации [79].
Все исследования изучающие влияние трансплантации прогениторных сосудистых клеток на неоангиогенез при КИНК, так или иначе, базируются на введении МНК КМ, большей или меньшей степени «чистоты». Способы доставки в основном представлены внутримышечным и внутрисосудистым введением. Разработка способов идентификации ПЭ и ЦЭК позволила ряду исследователей провести трансплантацию тканеспецифичных клеток [33, 35, 63].
Большинство исследований указывают на стойкий положительный эффект после аутологичной трансплантации СК больным с КИНК, в сроки до 6-8 месяцев. В 2006 г. учеными Японии закончено «пилотное» исследование по оценке отдаленных результатов трансплантации МНК больным с облитерирующим тромбангиитом [80]. Из 8 пациентов вошедших в исследование трое, отмечали непрекращающиеся боли в конечности, и у всех пациентов имело место язвенное поражение конечности. Через 4 недели отмечено улучшение клинического статуса у всех пациентов. Полное заживление язв произошло у 7 из 8 пациентов. Восстановление кровоснабжения в ишемизированных тканях нижних конечностей зависит от баланса между образованием кровеносных и лимфатических сосудов. Дисфункция лимфатической системы приводит к отеку, который является причиной длительно незаживающих язв. Введение VEGF-C ускоряет восстановления функции ишемизированной НК посредством увеличения скорости образования лимфатических и кровеносных микрососудов, уменьшением отека [81-83].
Нетромбогенные сосудистые протезы
Недавно, в хирургическом лечении атеросклероза коронарных артерий были применены аутологичные сосудистые протезы. Как альтернатива этому, биодеградирующая матрица обеспечила адекватную замену для сосудов большого калибра. Однако осложняющим фактором является образование тромбов на поверхности матрицы из-за контакта с кровью. Один из способов использования эндотелиальных прогениторных клеток, это образование нетромбогенных сосудистых клеток, которые бы покрывали поверхность сосудистого протеза. В одном из исследований, клетки КМ были внедрены в синтетический протез перед пересадкой его внутрь аорты собаки, это привело к формированию нетромбогенной эндотелиолизированной поверхности [95].
Аутологичные ЦЭК так же дифференцировались in vitro до зрелых эндотелиоцитов и последовательно «заселяли» протезы в сонных артериях. Это привело к образованию нетромбогенных функционально полноценных сосудов, которые оставались интактными на протяжении 120 дней, в противоположность тому как, в сосудистых протезах без эндотелиальной выстилки формировались тромбы. Сократимость и кислород-зависимая релаксация, измеряемые через 120 дней in vivo, были сходными с таковыми в нормальных артериях. Эти данные свидетельствуют о том, что предварительная выстилка сосудистых протезов эндотелием из выделенных ПЭ и ЦЭК облегчает ремоделирование in vivo, способствует формированию нетромбогенных эндотелизированных поверхностей.
Клинические осложнения, связанные с лечением стволовыми клетками
Внутривенное введение проангиогенных ПЭ и ЦЭК и ГСК может иметь неблагоприятные эффекты. Ряд исследований показали, что у мышей с гиперхолестеринемией, VEGF-A и иммунокомпетентные клетки могут ускорять образование атероматозных бляшек, посредством мобилизации ПЭ и моноцитов [96, 97]. Избежать этих потенциальных осложнений можно путем введения ПЭ, ЦЭК, ГСК и гематопоэтических прогениторных клеток непосредственно в места повреждения ткани избегая нежелательного заселения клетками других мест.
Внутрисосудистое или внутримышечное введение стволовых клеток?
Путь введения СК оказывает важное влияние на васкуляризацию тканей. Экспрессия молекул матрикса и адгезия поврежденными тканями обеспечивает захват рецепторами мобилизованных ЦЭК, ГСК и гематопоэтических прогениторных клеток при их внутрисосудистом введении.
В настоящее время установлено, что после повреждения сосудистой стенки ПЭ спонтанно поступают в кровоток [98-100]. Возникает вопрос, почему мобилизация этих клеток автоматически не восстанавливает реваскуляризацию тканей, и почему необходимо введение этих клеток инъекционным методом? Это объясняется тем, что ПЭ не достигают той степени дифференцировки, которая обеспечивает их внедрение в ишемизированную ткань. Альтернативным объяснением является то, что недостаточность кровотока в ишемизированной ткани мешает этим клеткам распознать поврежденные сосуды. Непосредственное введение ПЭ в зону повреждения позволяет обойти эти препятствия.
Генетическая модификация используемых факторов улучшает выживаемость и прикрепление сосудистых клеток. Выживаемость сосудистых клеток во время движения их к зоне повреждения является важным для внедрения клеток в ткань-мишень. Например, введение теломеразы гена обратной транскриптазы может увеличивать репликативный и восстановительный потенциал ПЭ [101].
Исследование стволовых клеток оказывает существенное влияние на жизнь миллионов людей во всем мире. Осознание того, что стволовые клетки открывают новые подходы к терапии многих заболеваний, требует от нас более детального изучения потенциала стволовых клеток. Данные, полученные о биологии стволовых клеток, стимулируют биомедицинское сообщество трансформировать эти находки для клинического применения. Стволовые клетки можно использовать для прямой трансплантации или для тканевой инженерии в комбинации с биоматериалами. Рассматривается возможность применения стволовых клеток для генной терапии как средства доставки генов или генетических продуктов к поврежденным тканям.
Литература
- Савельев В.С., Кошкин В.М., Критическая ишемия нижних конечностей – М., 1997. — 170 с.
- Second European Consensus Document on chronic critical leg ischemia // Circulation. – 1999, № 84 (IV). – Р.1-26.
- Dormandly J.A., Rotherford R.B., Management of peripheral arterial disease. TASC Group. Trans Atlantic Inter-Society Consensus // J. Vasc. Surg. – 2000, № 31. – Р.1-296.
- Смолянинов А.Б. Современные биотехнологические центры клеточных и генных технологий и банки стволовых клеток // Технология чистоты. — № 1, 2006. – С.4-5.
- Смолянинов А.Б. и соавт. Основы клеточной и генной терапии сердечно-сосудистых заболеваний. — М., 2005. — 192 с.
- Baumgartner I., Schainfeld R., Graziani L. Management of peripheral vascular disease // Annu. Rev. Med. – 2005, № 56. – Р.249-272.
- Vascular Society of Great Britain and Ireland // B.J.Surg. – 2007, № 94: issue 2. – Р.1-13.
- Emmerich J. Current state and perspective on medical treatment of critical leg ischemia: Gene and cell therapy. Int. J. of Lower Extremity Wounds. – 2005, № 4. – Р.234.
- Dorros G., Jaff M.R., Dorros A.M. et al. Tibioperoneal (outflow lesion) angioplasty can be used as primary treatment in 235 patients with critical limb ischemia: five-year follow-up // Circulation. – 2001, № 104. – Р.2057-62.
- Kudo T., Chandra F.A., Ahn S.S. The effectiveness of percutaneous transluminal angioplasty for the treatment of critical limb ischemia: a 10-year experience // J. Vasc. Surg. – 2005, № 41. – Р.:423-35.
- Faglia E., Dalla Paola L., et al. Peripheral angioplasty as the first-choice revascularization procedure in diabetic patients with critical limb ischemia prospective study of 993 consecutive patients hospitalized and followed between 1999 and 2003 // Eur. J. Vasc. Endovasc. Surg. – 2005, № 29. – Р.620-7.
- Leng G.C., Davis M., Baker D. Bypass surgery for chronic lower limb ischemia // Cochrane Database Syst. Rev. – 2000. — CD 0020000.
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. — М.: Медицина. – 1989. — 752 c.
- Schainfeld R.M., Isner J.M. Critical limb ischemia: nothing to give at the office? // Ann. Intern. Med. – 1999, № 130. – Р.442-4.
- Казьмин З.В. Комплексное хирургическое и консервативное лечение хронической критической ишемии при отсутствии условий прямой реваскуляризации нижних конечностей. Автореф. дис… канд. мед наук. — Москва. — 2006. – 35 с.
- Гавриленко А.В. Вестник Российской академии наук. – 2003, №12. – С.74-77.
- Nishikawa S.I., Nishikawa S., Hirashima M. et al.. Progressive lineage analysis by cell sorting and culture identifies FLK+VE-cadherin+ cells at a diverging point of endothelial and hemopoietic lineages. – Development. – 1998, № 125. – Р.1747–1757.
- Gehling U.M., Ergun S., Schumacher U. et al. In vitro differentiation of endothelial cells from AC133-positive progenitor cells // Blood. – 2000, №95. – Р.3106–3112.
- Asahara T., Murohara T., Sullivan A. et al. Isolation of putative progenitor endothelial cells for angiogenesis // Science. – 1997, № 275. – Р.964–967.
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. — Nat. Med. – 1995, № 1. – Р.27-31.
- Asahara T., Masuda H., Takahashi T. et al. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization // Circ. Res. – 1999, № 85. – Р.221–228.
- Reyes M., Dudek A., Jahagirdar B. et al. Origin of endothelial progenitors in human postnatal bone marrow // J. Clin. Invest. – 2002, № 109. – Р.337–346.
- Isner J.M., Pieczek A., Schainfeld R. et al. Clinical evidence of angiogenesis after arterial gene transfer of phVEGF165 in patient with ischaemic limb // Lancet. – 1996, № 348. – Р.370–374.
- Pearlman J.D., Hibberd M.G., Chuang M.L. et al. Magnetic resonance mapping demonstrates benefits of VEGF-induced myocardial angiogenesis // Nat. Med. – 1995, № 1. – Р.1085–1089.
- Baumgartner I.., Pieczek A., Manor O. et al. Constitutive expression of phVEGF165 after intramuscular gene transfer promotes collateral vessel development in patients with critical limb ischemia // Circulation. – 1998, № 97. – Р.1114–1123.
- Folkman J. Therapeutic angiogenesis in ischemic limbs // Circulation. – 1998, № 97. – Р.1108-1110.
- Hanahan D., Folkman J. Patterns and emerging mechanisms of the angiogenic switch during tumorogenesis // Cell. – 1996, № 86. – Р.353-364.
- Risau W. Mechanisms of angiogenesis // Nature. – 1997, № 386. – Р.671-674.
- Yancopoulos G.D. et al. Vascular-specific growth factors and blood vessel formation // Nature. – 2000, № 407. – Р.242-248.
- Carmeliet P., Jain R.K. Angiogenesis in cancer and other diseases // Nature. – 2000, № 407. – Р.249-257.
- Pepper M.S. Manipulating angiogenesis. From basic science to the bedside // Arterioscler. Thromb. Vasc. Biol. – 1997, № 17. – Р.605-619.
- Majka S.M. et al. Distinct progenitor populations in skeletal muscle are bone marrow derived and exhibit different cell fates during vascular regeneration // J. Clin. Invest. – 2000, № 111. – Р.71-79.
- Asahara T. et al. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization // Circ. Res. – 1999, № 85. – Р.221-228.
- Asahara T. et al. VEGF contributes to postnatal neovascularization by mobilizing bone marrow-derived endothelial progenitor cells // EMBO J. – 1999, № 18. – Р.3964-3972.
- Iwaguro H. et al. Endothelial progenitor cell vascular endothelial growth factor gene transfer for vascular regeneration // Circulation. – 2002, № 105. – Р.732-738.
- Kalka C. et al. Transplantation of ex vivo expanded endothelial progenitor cells for therapeutic neovascularization // Proc. Natl. Acad. Sci. USA. – 2002, № 97. – Р.3422-3427.
- Schatteman G.C., Hanlon H.D., Jiao, C. et al. Blood-derived angioblasts accelerate blood-flow restoration in diabetic mice // J. Clin. Invest. – 2000, № 106. – Р.571-578.
- Crosby J.R. et al. Endothelial cells of hematopoietic origin make a significant contribution to adult blood vessel formation // Circ. Res. – 2000, № 87. – Р.728-730.
- Takahashi T. et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization // Nat. Med. – 1999, № 5. – Р.434-438.
- Luttun A., Carmeliet G., Carmeliet, P. Vascular progenitors: from biology to treatment // Trends Cardiovasc. Med. – 2002, № 12. – Р.88-96.
- Rafii S. Circulating endothelial precursors: mystery, reality, and promise // J. Clin. Invest. – 2000, № 105. – Р.17-19.
- Shi Q. et al. Evidence for circulating bone marrow-derived endothelial cells // Blood. – 1998, № 92. – Р.362-367.
- Bhattacharya V. et al. Enhanced endothelialization and microvessel formation in polyester grafts seeded with CD34+ bone marrow cells // Blood. – 2000, № 95. – Р.581-585.
- Kaushal S. et al. Functional small-diameter neovessels created using endothelial progenitor cells expanded ex vivo // Nat. Med. – 2001, № 7. – Р.1035-1040.
- Noishiki Y., Tomizawa Y., Yamane Y., Matsumoto A. Autocrine angiogenic vascular prosthesis with bone marrow transplantation // Nat. Med.- 1996, № 2. – Р.90-93.
- Sata M. et al. Hematopoietic stem cells differentiate into vascular cells that participate in the pathogenesis of atherosclerosis // Nat. Med. – 2002, № 8. – Р.403-409.
- Young P.P., Hofling A.A., Sands, M.S. VEGF increases engraftment of bone marrow-derived endothelial progenitor cells (EPCs) into vasculature of newborn murine recipients // Proc. Natl. Acad. Sci. USA. – 2002, № 99. – Р.11951-11956.
- Lyden D. et al. Impaired recruitment of bone-marrow-derived endothelial and hematopoietic precursor cells blocks tumor angiogenesis and growth // Nat. Med. – 2001, № 7. – Р.1194-1201.
- Moore M.A. Putting the neo into neoangiogenesis // J. Clin. Invest. – 2002, № 109. – Р.313-315.
- Gehling U.M. et al. In vitro differentiation of endothelial cells from AC133-positive progenitor cells // Blood. – 2000, № 95. – Р.3106-3112.
- Marchetti S. et al. Endothelial cells genetically selected from differentiating mouse embryonic stem cells incorporate at sites of neovascularization in vivo // J. Cell. Sci. – 2002, № 115. – Р.2075-2085.
- Davidoff A.M. et al. Bone marrow-derived cells contribute to tumor neovasculature and, when modified to express an angiogenesis inhibitor, can restrict tumor growth in mice // Clin. Cancer Res. – 2001, № 7. – Р.2870-2879.
- Isner J.M. Myocardial gene therapy // Nature. – 2002, № 415. – Р.234-239.
- Khurana R., Simons M. Insights from angiogenesis trials using fibroblast growth factor for advanced arteriosclerotic disease // Trends Cardiovasc. Med. – 2003, № 13. – Р.116-122.
- Cao R. et al. Angiogenic synergism, vascular stability and improvement of hind-limb ischemia by a combination of PDGF-BB and FGF-2 // Nat. Med. – 2003, № 9. – Р.604-613.
- Carmeliet P. VEGF gene therapy: stimulating angiogenesis or angioma-genesis? // Nat. Med. – 2000, № 6. – Р.1102-1103.
- Sung-Whan Kim, Hoon Han, Gue-Tae Chae et al. Successful stem cell therapy using umbilical cord blood-derived multi-potent stem cells for Buerger’s disease and ischemic limb disease animal model // Stem Cells. – 2006, Vol.9, № 4. – Р.1128-34.
- Shintani S., Murohara T. et al. Augmentation of postnatal neovascularization with autologous bone marrow transplantation // Circulation. – 2001, № 103. – Р.897-908.
- Finney M.R., Greco N.J., Haynesworth S.E. et al. Direct comparison of umbilical cord blood versus bone marrow-derived endothelial precursor cells in mediating neovascularization in response to vascular ischemia // Biol. Blood Marrow Transpl. – 2006, № 12(5). – Р.585-93.
- Dong-Ik Kim, Mi-Jung Kim, Jin-Hyun Joh Angiogenesis facilitated by autologous whole bone marrow stem cell transplantation for Buerger’s disease // Stem Cells. – 2006, Vol. 24, №5. –P.1194-1200.
- Schatteman G.C., Dunnwald M., Jiao C. et al. Biology of bone marrow-derived endothelial cell precursors // Am. J. Physiol. Heart Circ. Physiol. – 2007, № 292. – Р.1-18.
- Kinnaird T., Stabile E., Burnett M.S., Epstein S.E. Bone marrow–derived cells for enhancing collateral development: Mechanisms, animal data, and initial clinical experiences // Circ. Res. – 2004, № 95. – Р.354-62.
- Miyamoto K.et al. Molecular evaluation of endothelial progenitor patients with ischemic limbs // Ather., Thromb., and Vasc. Biology. – 2004, № 24. – Р.192-202.
- Schatteman G.C., Dunnwald M., Jiao C. Biology of bone marrow-derived endothelial cell precursors // Am. J. Physiol. Heart. Circ. Physiol. – 2007, Vol.292, № 1. – Р.1-18.
- Shi Q., Bhattacharya V., Hong-De Wu M., Sauvage, L.R. Utilizing granulocyte colony-stimulating factor to enhance vascular graft endothelialization from circulating blood cells // Ann. Vasc. Surg. – 2002, 16. – Р.314-320.
- Jiang Y. et al. Pluripotency of mesenchymal stem cells derived from adult marrow // Nature. – 2002, № 418. – Р.41-49.
- Tateishi-Yuyama E., Matsubara H., Murohara T. et al. Therapeutic angiogenesis for patients with limb ischemia by autologous transplantation of bone-marrow cells: a pilot study and randomized controlled trial // Lancet. – 2002, № 360. – Р.427-435.
- Higashi Y., Kimura M., Hara K. Autologous bone-marrow mononuclear cell implantation improves endothelium-dependent vasodilatation in patients with limb ischemia // Circulation. – 2004, № 109. – Р.1215-18.
- Saigawa T., Kato K., Ozawa T. Et al. Clinical application of bone-marrow implantation in patients with arteriosclerosis obliterans, and the association between efficacy and the number of implanted bone-marrow cells // Circ. J. – 2004, № 68. – Р.1189-93.
- Iba O. et al. Angiogenesis is by implantation of peripheral blood mononuclear cells and platelets into ischemic limbs // Circulation. – 2002, № 106. – Р.2019-25.
- Dzau V.J., Braun-Dullaeus R.C., Sedding D.G. Vascular proliferation and atherosclerosis: New perspectives and therapeutic strategies // Nat. Med. – 2002, № 8. – Р.1249-56.
- Ribatti D., Vacca A., Roncali L., Dammacco, F. Hematopoiesis and angiogenesis: a link between two apparently independent processes // J. Hematother. Stem Cell Res. – 2000, № 9. — Р.13-19.
- Hattori K. et al. Vascular endothelial growth factor and angiopoietin-1 stimulate postnatal hematopoiesis by recruitment of vasculogenic and he-matopoietic stem cells // J. Exp. Med. – 2001, № 93. – Р.1005-14.
- Al-Khaldi A., et al. Therapeutic angiogenesis using autologous bone marrow stromal cells: improved blood flow in a chronic limb ischemia model // Ann. Thorac. Surg. – 2003, № 75 (1). – Р.204-209.
- Pesce M., Orlandi A., Iachininoto M.G. et al. Myoendothelial Differentiation of Human Umbilical Cord Blood–Derived Stem Cells in Ischemic Limb Tissues // Circ. Res. – 2003, № 93. – Р.51.
- Nakagami H.; Maeda K.; Morishita R. Novel autologous cell Therapy in Ischemic Limb Disease Through Growth Factor Secretion by Cultured Adipose Tissue–Derived Stromal Cells // Arterioscler., Thromb., and Vasc. Biol. – 2005, № 25. – Р.25-42.
- Esato K. et al. Neovascularization induced by autologous bone cells implantation in peripheral arterial disease // Cell Transplant. – 2002, Vol.11, № 8. – Р.747-752.
- Huang P.P. et al. Autologous transplantation of peripheral blood stem cells as an effective therapeutic approach for severe arteriosclerosis obliterans of lower extremities // Thromb. Haemost. – 2004, № 91. – Р.606-9.
- Van Royen N., Schirmer S.H., Atasever B. et al. START Trial: a pilot study on stimulation of arteriogenesis using subcutaneous application of granulocyte-macrophage-colony-stimulating factor as a new treatment for peripheral vascular disease // Circulation. – 2005, № 112. – Р.1040-49.
- Miyamoto K., Nishigami K. et al. Unblinded pilot study of autologous transplantation of bone marrow mononuclears in patients with thromboangiitis obliterans // Circulation. – 2006, № 114. – Р.2679-84.
- Yoon, Y.S. et al. VEGF-C gene therapy augments postnatal lymphangiogenesis and ameliorates secondary lymphedema // J. Clin. Invest. – 2003, № 111. – Р.717-25.
- Saaristo, A., Karkkainen, M.J. & Alitalo, K. Insights into the molecular pathogenesis and targeted treatment of lymphedema // Ann. NY Acad. Sci. – 2002, № 979. – Р.94-110.
- Szuba A. et al. Therapeutic lymphangiogenesis with human recombinant VEGF // C. FASEB J. – 2002, № 16. – Р.1985-87.
- Sata M. et al. Hematopoietic stem cells differentiate into vascular cells that participate in the pathogenesis of atherosclerosis // Nat. Med. – 2002, № 8. – Р.403-9.
- Caplice N.M. et al. Smooth muscle cells in human coronary atherosclerosis can originate from cells administered at marrow transplantation // Proc. Natl. Acad. Sci. USA. – 2003, № 100. – Р.4754-59.
- Hill J.M. et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk // N. Engl. J. Med. – 2003, № 348. – Р.593-600.
- Hillebrands J.L., Klatter F.A., van Dijk W.D. Rozing, J. Bone marrow does not contribute substantially to endothelial-cell replacement in transplant arteriosclerosis // Nat. Med. – 2002, № 8. – Р.194-195.
- Wagers A.J., Sherwood R.I.., Christensen J.L., Weissman, I.L. Little evidence for developmental plasticity of adult hematopoietic stem cells // Science. – 2002, № 297. – Р.2256-59.
- Rehman J., Li J., Orschell C.M., March, K.L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors // Circulation. – 2003, № 107. – Р.1164-69.
- Solovey A.N. et al. Identification and functional assessment of endothelial P1H12 // J. Lab. Clin. Med. – 2001, № 138. – Р.322-31.
- Peichev M. et al. Expression of VEGFR-2 and AC133 by circulating human CD34(+) cells identifies a population of functional endothelial precursors // Blood. – 2000, № 95. – Р.952-8.
- Hillebrands J.L., Klatter F.A., Rozing J. Origin of vascular smooth muscle cells and the role of circulating stem cells in transplant arteriosclerosis // Arterioscler. Thromb. Vasc. Biol. – 2003, № 23. – Р.380-7.
- Shimizu K. et al. Host bone-marrow cells are a source of donor intimal smooth- muscle-like cells in murine aortic transplant arteriopathy // Nat. Med. – 2001, № 7. – Р.738-41.
- Hu Y. et al. Smooth muscle cells in transplant atherosclerotic lesions are originated from recipients, but not bone marrow progenitor cells // Circulation. – 2002, № 106. – Р.1834-9.
- Noishiki Y., Tomizawa Y., Yamane Y., Matsumoto, A. Autocrine angiogenic vascular prosthesis with bone marrow transplantation // Nat. Med. – 1996, № 2. – Р.90-93.
- Celletti F.L. et al. Vascular endothelial growth factor enhances atherosclerotic plaque progression // Nat. Med. – 2001, № 1. – Р.425-9.
- Van Royen N. et al. Local monocyte chemoattractant protein-1 therapy increases collateral artery formation in apolipoprotein E-deficient mice but induces systemic monocytic CD11b expression, neointimal formation, and plaque progression // Circ. Res. – 2003, № 92. – Р.218-25.
- Gill M. et al. Vascular trauma induces rapid but transient mobilization of VEGFR2(+)AC133(+) endothelial precursor cells // Circ. Res. – 2001, № 88. – Р.167-174.
- Vasa M. et al. Increase in circulating endothelial progenitor cells by statin therapy in patients with stable coronary artery disease // Circulation. – 2001, № 103. – Р.2885-90.
- Shintani S. et al. Mobilization of endothelial progenitor cells in patients with acute myocardial infarction // Circulation. – 2001, № 103. – Р.2776-79.
- Murasawa S. et al. Constitutive human telomerase reverse transcriptase expression enhances regenerative properties of endothelial progenitor cells // Circulation. – 2002, № 106. – Р.1133-9.

