Оценка возможности применения фибринового клея на основе пуповинной крови в качестве скаффолда для мезенхимальных стволовых клеток
Assessing the possibility to apply the fibrin glue by cord blood plasma as a scaffold for mesenchymal stem cells transplantation
Енукашвили Н.И.,2,3, Айзенштадт А.А.1,2, Багаева В.В.1, Супильникова О.В.1,2, ИволгинД.А.1,2, Масленникова И.И.1,2, Новикова С.В.1, Адылов Ш.Ф.1
Enukashvily N.I.,2,3, Aizenshtadt A.A.1,2, Bagaeva V.V.1, Supilnikova O.V.1,2, Ivolgin D.A.1,2, Maslennikova I.I.1,2, Novikova S.V.1, Adylov Sh.F1
1. ООО «Покровский банк стволовых клеток», 2. СЗГМУб НИЛ клеточных технологий, 3 Институт цитологии РАН
Natella Enukashvily nie@newmail.ru ,+7(950)020-58-02
Мезенхимальные стволовые клетки (МСК) и получаемые из них прехондроциты (МСК-ПХ) являются эффективным инструментом для восстановления и поддержания суставных хрящей. Данный подход основан на использовании МСК как а) предшественников хондроцитов для формирования хрящевых имплантатов, б) продуцентов большого количества биологически активных факторов в области имплантации. Доставка МСК и МСК-ПХ в поврежденный сустав может быть произведена путем внутрисуставной имплантации клеток в скаффолдах, обеспечивающих удержание клеток в области инъекции и дополнительное снабжение клеток биологически активными веществами. Скаффолды, основанные на фибриновом клее (ФК) представляются перспективными вследствие высокой биосовместимости, способности к биодеградации, удобства использования. ФК из криопреципитатов аутологичной плазмы (Ау-ФК) пациента или аллогенной плазмы пуповинной крови (ПК-ФК) в некоторых случаях может рассматриваться как более предпочтительный вариант готовым коммерческим продуктам. К достоинствам Ау-ФК относятся минимизация побочных эффектов, рисков инфицирования и возникновения аллергических реакций, доступность и снижение стоимости процедуры. ПК-ФК обогащен биологически активными веществами и получается из утилизируемого в процессе сохранения стволовых клеток пуповинной крови материала.
Мы разработали протокол, позволяющий получать ФК в закрытой системе в течение всего процесса от забора крови до самой процедуры трансплантации, что делает возможным клиническое применение Ау-ФК и ПК-ФК. А также показали, что культивирование в Ау-ФК и ПК-ФК не приводит к изменению иммунофенотипа клеток и уровню их пролиферации и оказывает стимулирующее влияние на хондрогенную дифференцировку.
Ключевые слова: Мезенхимальные стволовые клетки, фибриновый клей, плазма пуповинной крови, аутологичная плазма.
Mesenchymal stem cells (MSCs) and pre-chondrocytes (MSK-Ch) derived from them are an effective tool for the restoration and maintenance of joint cartilage. This approach is based on the use of MSCs as a) chondrocyte precursor to form a cartilaginous implant, b) producing a large number of bioactive factors in the area of implantation. Delivery of MSC and MSC-Ch into the damaged joint can be achieved by the implantation of scaffold with cells to ensure retention of the cells at the injection site and an additional supply of cells of biologically active substances.
Scaffold based on fibrin glue (FG) are promising because of the high biocompatibility, biodegradability, ease of use. FG cryoprecipitate of autologous plasma (Au-FG) patient or allogeneic umbilical cord blood plasma (UCB-FG) in some cases may be regarded as a preferred embodiment of ready commercial products. The advantages of the Au-FG are to minimize the side effects, risks of infection and the occurrence of allergic reactions, availability and reduced cost of the procedure. UCB-FG is enriched with biologically active substances and derived from byproduct during collection stem cells from the cord blood.
We have developed a protocol that allows to obtain FG in a closed system throughout the entire process of blood sampling until the transplant procedure, which makes it possible clinical application of the Au-FG and UCB-FG. Also shown that cultivation in Au-FG and UCB-FG does not change the immunophenotype of cells and the level of their proliferation and has a stimulating effect on chondrogenic differentiation.
Keywords: Mesenchymal stem cells, fibrin glue, umbilical cord blood plasma, autologous plasma.
Введение:
Локальные посттравматические повреждения хряща, а также дегенеративно-дистрофические повреждения хряща, такие как болезнь Кенига, остеоартроз 1-2 стадии являются распространенным заболеванием. По статистике, от данной группы заболеваний в некоторых странах страдает до 22% населения.
Таким образом, восстановление хряща является актуальной проблемой современной травматологии и ортопедии. На данный момент, несмотря на разнообразие применяемых для регенерации суставной поверхности методик, не существует адекватного подхода, который обеспечивал бы полное и долговременное восстановление структуры и функциональной активности поврежденного сустава.
Одним из перспективных подходов является использование биотрансплантатов, основой для которых могут служить аутологичные хондроциты или мезенхимные стромальные клетки (аутологичные или аллогенные).
Использование аутологичных хондроцитов имеет ряд недостатков. Сниженная пролиферативная активность осложняет получение необходимого для терапевтического применения количества клеточного материала. Кроме того, инвазивная процедура забора фрагмента хрящевой ткани сопряжена с риском возникновения серьезных осложнений в области забора материала – donor site morbidity
Альтернативой является применение мезенхимных стромальных клеток (МСК), которые обладают способностью дифференцироваться в клетки тканей мезенхимного ряда, в том числе, в хондроциты (Pittenger et al., 1999; Barry et al., 2004, Heng et al., 2004; Solchaga et al., 2011). МСК обладают более высоким пролиферативным потенциалом по сравнению с хондроцитами. Хондроциты, полученные в результате дифференцировки из МСК, сохраняют способность делиться в течение более длительного периода, чем хондроциты, выделенные из фрагмента суставного хряща.
Исторически сложилось, что основным источником материала для исследований МСК длительное время служил костный мозг лабораторных животных и человека. Однако процедура забора костного мозга достаточно травматична, требует медикаментозной подготовки пациента, пребывания его в госпитале в течение суток, существует риск серьезных осложнений. В настоящее время известно, что МСК также можно получить из пуповинной крови, пупочного канатика и жировой ткани, а также из мобилизованной периферической крови (Wagner et al., 2005, Jin HJ et al., 2013). По нашим данным, МСК из жировой ткани и пупочного канатика по своим свойствам очень близки к МСК, выделенным из костного мозга. А МСК из пупочного канатика по своему пролиферативному потенциалу даже превосходят клетки, полученные из костного мозга (Айзенштадт и др., 2015).
Для создания трансплантата нужной формы, доставки клеток, удержания их на месте инъекции, создания оптимальной среды для роста, а также для усиления лечебного эффекта от применения МСК используются различные поддерживающие матрицы (т.н. скаффолды). Разрабатываются скаффолды с разными физическими и химическими свойствами, в том числе гидрогели на основе различных компонентов (напр. гиалуроновой кислоты или фибрина). К достоинствам гидрогелей можно отнести высокое содержание жидкости и способность после полимеризации надежно удерживать клетки (Slaughter et al., 2009). Гель на основе фибрина (т.н. фибриновый клей) обладает рядом уникальных преимуществ: (а) для его создания возможно использование как аллогенной, так и аутологичной плазмы в качестве источника фибриногена, (б) полимеризация геля происходит при участии нецитотоксичных инициаторов (тромбин, соли кальция) (в) сам гель обладает достаточно прочной структурой, обеспечивающей надежное удержание клеток в месте инъекции, (г) наличие значительного объема воды в геле позволяет вводить в него различные биологически активные вещества, в т.ч. дифференцировочные факторы, противовоспалительные препараты и т.д, (д) фибрин является биодеградируемым материалом (Jockenhoevel et al., 2001; Swartz et al., 2005; Ahmed et al., 2008). Помимо этого, в тех случаях, когда нежелателен забор у пациента значительных объемов крови для получения нужного количества плазмы, в качестве источника фибриногена может использоваться и аллогенная плазма, в том числе плазма пуповинной крови. Плазма пуповинной крови по своему составу значительно богаче биологически активными веществами и ростовыми факторами по сравнению с плазмой крови взрослого человека (Fahdnis et al., 2006; Tekkatte et al., 2011; Pereira et al., 2014). Антиоксидантные свойства такой плазмы выше, чем у плазмы взрослого человека (Wiedemann et al., 2003) Дополнительным достоинством такого метода является возможность использования плазмы, не используемой в трансфузиологии и обычно утилизируемой после выделения ядросодержащей фракции. Однако, использование плазмы пуповинной крови для приготовления фибринового клея теоретически может быть осложнено следующими факторами: (а) плазма пуповинной крови характеризуется меньшей вязкостью и (б) более низким содержанием фибриногена (в среднем 1.8 г/л) по сравнению с плазмой взрослого человека (референтные значения 2-4 г/л, 4,25 г/л у беременных женщин)) (Teger-Nilsson et ., 1974; Foley et al., 1978) в) повышенным содержанием фетальной формы фибриногена (фибриногена-420), снижающего скорость полимеризации фибрина и меняющего структуру фибриновых волокон (Mosesson et al., 2004). Помимо этого плазма пуповинной крови обычно содержит значительный объем антикоагулянта в связи с тем, что образцы крови (малого объема – 40-100 мл) обычно собирают в стандартные мешки для сбора крови, рассчитанные на 450 мл и содержащие около 50 мл антикоагулянта. Вместе с тем, степень фосфориллирования фибриногена и зависимость тромбинового времени от концентрации солей кальция значительно сильнее выражена у новорожденных по сравнению со взрослыми (Hamulyak et al., 1983).
Криопреципитация является одним из методов повышения концентрации фибриногена. (Pool et al., 1964). Криопреципитат представляет собой плохорастворимый концентрат высокомолекулярных белков плазмы, получаемых при медленной разморозке плазмы при температуре 1-6°С до консистенции «снежной кашицы» («slushy»). Он обогащен коагулирующими белками плазмы, такими как фактор VIII, фибриноген, фактор фон Виллебранда, фибронектином. Концентрация фибриногена в криопреципитате возрастает в 2-10 раз по сравнению с плазмой. Остающаяся после криопреципитации плазма обеднена этими белками, но содержит все остальные компоненты плазмы и поэтому часто используется в качестве растворителя для криопреципитата перед его использованием.
Мы предположили, что использование метода криопреципитации для обогащения плазмы фибриногеном позволит использовать плазму пуповинной крови для приготовления фибринового клея.
Цель работы:
Целью данного исследования являлась оценка возможности использования фибринового клея на основе криопреципитата из плазмы пуповинной крови в качестве скаффолда для мезенхимальных стволовых клеток для последующего их применения при лечении дегенеративных поражений суставного хряща.
Материалы и методы:
Клеточные культуры:
Образцы подкожной жировой ткани объемом 2-4 мл были получены в ходе липоэктомии с наружной поверхности бедра по стандартной методике. Ткань извлекали из контейнера с транспортной средой, механически измельчали, затем инкубировали при 37 С в 0,2 % растворе коллагеназы (тип I, Sigma-Aldrich, США) в ФСР. Диссоциированные клетки отмывали от фермента центрифугированием (400 G, 10 мин) и высевали во флаконы при плотности 100–400 тыс. кл/см2. Смену среды проводили также через 72 ч
Пупочные канатики получали при неосложненных родах при наличии информированного согласия. МСК выделяли из периваскулярного пространства пупочной вены методом ферментативной обработки с помощью смеси коллагеназ I и IV. Далее клетки культивировали в питательной среде AdvanceSTEM Mesenchymal Stem Cell media (HyClone), содержащей 10% заменителя сыворотки AdvanceSTEM Mesenchymal Stem Cell Supplement (HyClone), 50 ед/мл пенициллина и 50 мкг/мл стрептомицина (далее «полная культуральная среда»). При достижении 70-80 % конфлюентности монослоя МСК, клетки пересевали (не более 2 раз) при плотности 1000 кл/см2.
МСК культивировали в условиях гипоксии при 37оС в атмосфере 5% СО2 и 5% О2 с использованием мультигазовых инкубаторов (BBD 6220, Thermo Scientific, США) с возможностью подачи азота.
Получение обедненной тромбоцитами плазмы и криопреципитата.
Криопреципитат получали из плазмы пуповинной крови, непригодной для выделения ядросодержащей фракции по причине малого веса образца. Образцы пуповинной крови получали при неосложненных родах, при наличии информированного согласия. В исследовании использовали образцы с группой крови A или AB, т.к. в таких образцах выше содержание в плазме фактора VIII.
Образцы пуповинной крови объемом 70,1±18,4 мл (из них объем антикоагулянта — ЦФДА, цитрат-фосфат-декстроза-аденин — составлял 49 мл) центрифугировали (10 мин при 250 g) в закрытой системе из двух полимерных контейнеров для сбора крови (Green Cross Medical Science Corporation, Корея). Эритроцитарную массу и плазму разделяли с помощью плазмоэкстрактора Ностальгия (Россия). Далее для получения криопреципитата следовали, в основном, протоколу Американской ассоциации Банков Крови (AABB technical manual, 15th edition) с нашими модификациями. К пакету с плазмой подсоединяли пластиковый контейнер (Компопласт, Россия) и повторно центрифугировали при 4500 g 10 мин при комнатной температуре и затем с помощью плазмоэкстрактора отделяли супернатант (обедненная по тромбоцитам плазма – platelet poor plasma) от осадка (остаточные эритроциты, тромбоциты). Часть плазмы (1 мл) использовали для определения количества фибриногена стандартными клиническими методами. Полученную плазму (30±15 мл из одного образца крови) замораживали и хранили в пластиковых контейнерах с запаянными портами при -80С в течение 1-18 дней.
Для получения криопреципитата образец плазмы медленно размораживали при температуре +4-+6С до консистенции «снежной кашицы» («slushy»). Криопреципитат отделяли от остальной плазмы одним из двух методов: а) центрифугированием при 4500 g 10 мин при +4С и последующим пассивным сливанием плазмы в подсоединенный пакет или б) разделением замороженных кристаллов и растаявшей плазмы с помощью плазмоэкстрактора. После разделения и окончательного растаивания криопреципитата хлопья криопреципитированных высокомолекулярных белков плазмы растворяли в оставшейся в пакете плазме (примерно 10-15 мл), прогревая пакет до комнатной температуры. Далее полученный криопреципитат немедленно замораживали. Количество фибриногена определяли во всех фракциях (обедненная по тромбоцитам плазма, криопреципитат, отделенная от него (cryo-depleted) остаточная плазма).
Приготовление фибринового клея
При приготовлении фибринового клея с ресуспендированными в нем МСК, в основном, следовали протоколу Новозеландского Банка Крови (http://www.nzblood.co.nz/assets/Transfusion-Medicine/PDFs/Fibrin-Glue-111I027.pdf) с нашими модификациями.
Для получения фибринового клея с иммобилизованными в нем клетками использовали двухкомпонентную систему, состоящую из размороженного криопреципитата с ресуспендированными в нем клетками (3*105/мл или 106/мл) и тромбинового раствора. Два компонента смешивались непосредственно перед внесением в лунку 6-луночного планшета.
Тромбин (Baxter или Технология-Стандарт, Новосибирск) растворяли до концентрации 200U/мл или 32.5U/мл в полной культуральной среде (см. выше), что отличается от стандартного протокола получения клея для хирургии, однако повышает выживаемость МСК. Для предотвращения фибринолиза и повышения коагулирующих свойств тромбинового раствора в полную культуральную среду перед внесением тромбина добавляли ингибитор фибринолиза аминокапроновую кислоту (до 2 г/л) и хлорид кальция (2 г/л). Приготовленный таким образом раствор использовали в течение трех часов.
МСК выращивали как описано выше до 70-80% конфлюэнтности. Клетки снимали с подложки раствором 0,25% трипсина (Gibco). Затем их ресуспендировали в 5 мл полной культуральной среды и центрифугировали при 800g 5 мин. Осевшие клетки ресуспендировали в свежеразмороженном криопреципитате таким образом, чтобы их концентрация составляла 3*105/мл или 106/мл.
Смешивание тромбинового раствора (0,5 мл) и МСК-содержащего криопреципитата (0,5 мл) осуществляли с помощью аппликационного набора DUPLOJECT (Baxter) — системы из двух шприцов с общей иглой — непосредственно в момент внесения клея с клетками в лунки 6-луночного планшета
Культивирование клеток в фибриновом клее
После завершения полимеризации фибринового клея с ресуспендированными клетками в лунки планшета над фибриновым сгустком наслаивали полную культуральную среду (2 мл) и культивировали клетки в условиях гипоксии как описано выше в течение 7 дней. Смену среды осуществляли каждые 2 дня. Исследовали клетки, как растущие в геле, так и покинувшие его. Методами световой микроскопии оценивали внешний вид клеток, число клеток, растущих вне геля, число одиночных клеток и колоний в геле. Через 7 дней фибриновый сгусток удаляли, а покинувшие его клетки (примерно 20% от общего числа клеток в лунке) использовали для изучения способности клеток из фибринового клея дифференцироваться в хондроцитарном направлении.
Дифференцировка в хондроцитарном направлении клеток, полученных из фибринового клея.
Клетки, покинувшие гель, культивировали до достижения ими 60-70% конфлюэнтности и далее переносили в хондрогенную культуральную среду, содержащую 10% хондрогенного заменителя сыворотки (hMSC Mesenchymal Stem Cell Chondrocyte Differentiation Medium, Lonza) и культивировали согласно протоколу производителя. Морфологию клеток оценивали на 3, 7 и 10 день от переноса в хондрогенную среду методами световой микроскопии.
Иммунофенотипирование полученных клеток.
Однородность выделенных первичных МСК, а также дифференцированных клеток, оценивали по экспрессии специфических поверхностных антигенов — иммунофенотипических маркеров методом проточной цитофлуорометрии. Поверхностные маркеры МСК выявляли с помощью меченных флуорохромами антител против CD10, CD13, CD34, CD44, CD45, CD73, CD90, CD105 и CD117 (Beckman Coulter, США) на проточном цитофлуориметре FC500 (Beckman Coulter, США) в соответствии с инструкцией фирмы производителя. Анализ полученных данных проводили с помощью программного обеспечения CXP.
Окраска альциановым синим
Клетки выращивали и дифференцировали на покровных стеклах. Образцы дважды промывали фосфатным буфером и фиксировали 4% параформальдегидом 10 минут при комнатной температуре. Далее проводили окрашивание альциановым синим (рН 2,5), используя стандартный протокол. Анализ данных проводили методом световой микроскопии (Zeiss Axiovert 40c).
Статистические методы
В ходе эксперимента проанализировано 8 образцов криопреципитата. Эксперименты с культивированием клеток в фибриновом клее повторяли три раза. Результаты представлены как среднее±ошибка среднего. Для определения нормальности распределения переменных проводился тест Колмогорова-Смирнова/ Статистический анализ проводился с использованием t-критерия Стьюдента, ANOVA для связанных значений. Критический уровень значимости был принят p<0,05. Применялся стандартный пакет прикладных программ: GraphPad Prism, Microsoft Excel 2003.
Результаты и обсуждение:
Результаты измерения количества фибриногена в обедненной по тромбоцитам (PPP) плазме, криопреципитате и остаточной плазме представлены на рис. 1. Исходное количество фибриногена в PPP-плазме (1,60±0,08 г/л) было ниже нормы взрослого человека (2-4 г/л), а также среднего значения для концентрации фибриногена в пуповинной крови, 1.8 г/л (Foley et al., 1978). Такое низкое содержание фибриногена в плазме обусловлено как физиологическими свойствами плазмы пуповинной крови, так и довольно значительным (в 0,5-2 раза) разведением крови при заборе в стандартный контейнер. Помимо снижения концентрации фибриногена, наличие такого большого количества антикоагулянта меняет ионную силу раствора и концентрации солей, что также вносит погрешность в измерение тромбинового времени, что является основой метода измерения концентрации фибриногена. (Момот, 2006)
Образцы свежеразмороженного криопреципитата содержали фибриноген в количествах (2,25±0,14 г/л), меньше рекомендованных AABB (7-14 г/л), что связано с более низким содержанием фибриногена в исходной плазме по причинам описанным выше. Также содержание фибриногена в получаемом нами криопреципитате было ниже по сравнению с коммерчески производимым препаратом фибриногена, используемом в препарате Тиссукол (60-70г/л). Однако данный препарат был разработан, прежде всего, для использования в хирургии для удержания краев раны. Механические характеристики получаемого нами геля достаточны для получения прочного сгустка и удерживания в нем МСК (рис. 2). Кроме того, по данным Но со соавторами (Ho et al, 2006), низкое (5 г/л) содержание фибриногена обеспечивает более высокую скорость пролиферации клеток. При этом относительно мягкая, крупнопористая структура получаемого геля в данном случае играет положительную роль, т.к. облегчается миграция клеток и диффузия биологически активных веществ из/в гель. Помимо этого мы используем достаточно большое количество остаточной плазмы для растворения криопреципитата (1/3 от исходного объема плазмы), что также приводит к снижению концентрации фибриногена. Однако, с другой стороны, это позволяет увеличить концентрацию в криопреципитате некоторых удаляемых из него факторов, например, фактора XIII, который необходим для взаимодействия фибрина с фибронектином и коллагеном (Radosevich et al., 1997), а также для жизнедеятельности МСК (Lee et al., 2008).
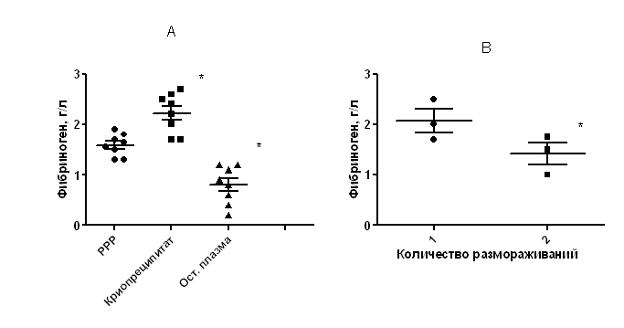
При повторном замораживании-размораживании криопреципитата количество фибриногена снижалось на 40%. (рис. 1В). Однако, даже при использовании такого криопреципитата мы получали сгусток удовлетворительной механической прочности.
Время полимеризации фибринового клея зависело от количества тромбина в фибриновом клее (табл. 1). Статистически достоверных отличий между тромбином различных производителей выявлено не было (табл. 1). Значительная вариабельность параметра связана с различным содержанием фибриногена в криопреципитате. Различное содержание фибриногена приводило также к тому, что в образцах с низким содержанием белка (менее 1,4 г/л), наблюдалось сжатие фибринового геля на 2-3 день культивирования. В будущем мы планируем добиться меньшей вариабельности за счет разработки внутреннего стандарта лаборатории по содержанию фибриногена в криопреципитате.
Концентрация тромбина | ||
|---|---|---|
200 U/мл | 32,5 U/мл | |
Baxter | 2 — 10 c | 20 — 50 c |
Новосибирск-технология | 5 — 12 с | 20 — 60 с |
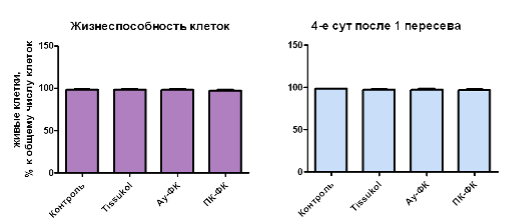
Визуальный анализ клеток растущих в геле показал, что основная их часть (до 80%) не покидает гель (рис. 1B). Клетки имеют сферическую форму, некоторые клетки при делении образуют небольшие колонии (4-14 клеток), крупные колонии при культивировании в течение 7 дней наблюдаются, но редко (3-4 на лунку). Считается, что фактор XIII, содержащийся в плазме и криопреципитате, облегчает миграцию МСК и усиливает их пролиферативную активность (Lee, 2008). В получаемых нами образцах МСК, культивируемых в стандартных условиях, а также в фибриновом клее на основе плазмы пуповинной крови или периферической крови не было показано достоверных отличий пролиферативного потенциала МСК а также жизнеспособности клеток. (рис. 2.)Уровень экспрессии поверхностных маркеров CD90, CD105, CD73, CD44, CD13, CD10, CD34, CD45, CD117 и CD14 также не зависел от способа культивирования (табл. 2).
Маркерный антиген | CD 34 | CD 45 | CD 117 | CD 14 | CD 44 | CD 13 | CD 73 | CD 90 | CD 105 | CD 10 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
Доля клеток (%), несущих антигены в культуре, полученной из | пупочный канатик | 0,1 | 2,8 | 3,8 | 1,7 | 98,1 | 98,3 | 96,5 | 98 | 97,5 | 74,8 |
Дифференцированные МСК | 6,7 | 1,9 | 1,3 | 6,5 | 98,7 | 96,3 | 99,3 | 98,9 | 98,4 | 22,1 |
Табл. 2. Измерение уровня поверхностных маркерных антигенов в МСК пупочного канатика и дифференцированных МСК в хондрогенном направлении.
Влияние фибринового клея на поведение имплантата с МСК в хрящевой ткани пока мало изучено, однако известно, что фибриновый клей ускоряет ангиогенез (за счет хемотаксиса), ускоряет пролиферативную активность МСК и синтез матрикса остеоцитами при аппликации в область повреждения костной ткани (Isogai et al., 2000; Lee et a., 2008, Wu et al., 2012). Ускорение ангиогенеза и роста гладкомышечной ткани при использовании МСК в скаффолде на основе фибринового клея показано также на модели повреждениях уретры кроликов (Wang et al., 2012). Предпринимались попытки использовать фибриновый гель для предимплантационного культивирования аутологичных хондроцитов и в качестве скаффолда для имлантации хондроцитов (Scotti et al., 2010). Показано, что культивирование в фибриновом геле усиливает выработку матрикса хондроцитами. В этом отношении влияние фибринового клея сходно с влиянием альгинатов. Однако этот эффект значительно варьирует в зависимости от состава фибринового клея, а именно от соотношения в нем тромбина и фибриногена.
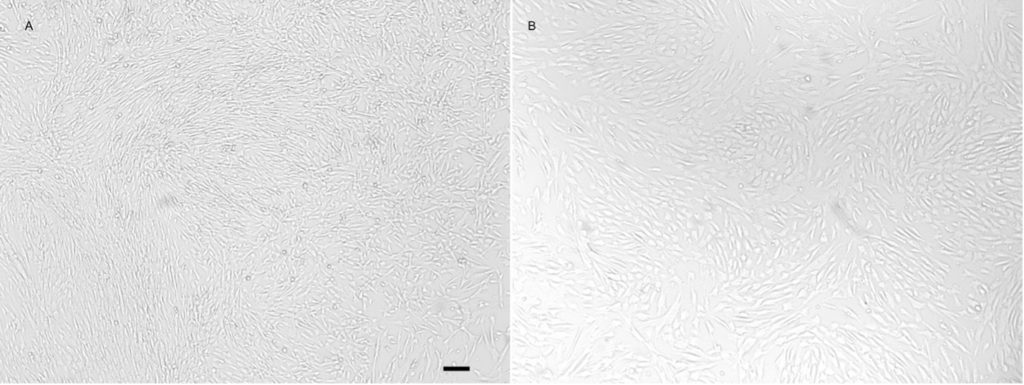
При достаточно большой концентрации клеток в фибриновом клее (0,7-3*106/мл клея, что соответствует концентрации при аппликации) часть клеток покидает сгусток. После удаления сгустка на 7 день оставшиеся в лунке клетки продолжают активно делиться (рис. 3C). К 3-4 дню после удаления сгустка МСК формировали монослой на пластиковой подложке (рис. 3D). В условиях культуры клеток мы удаляли остаточный сгусток. В условиях in vivo фибрин также подвергается биодеградации, но достаточно медленной. Присутствие ингибиторов фибринолиза (аминокапроновой кислоты в наших экспериментах) дополнительно снижает эту скорость. Способность фибрина к биодеградации является достоинством этого материала.

Проведенные эксперименты показали, что после ресуспендирования в фибриновом клее клетки не утрачивают своей способности к диффренцировке в хондрогенном направлении (рис. 4). После смены среды на хондрогенную отчетливые изменения (округление и укрупнение клеток, образование округлых скоплений вместо продольных тяжей) наблюдались уже на 3 день. Этот срок несколько меньше по сравнению с МСК, которые росли только на пластиковой подложке.
Изменение морфологии клеток сопровождалось изменением уровня экспрессии глюкозамингликанов, которые являются структурными компонентами межклеточного матрикса нативного хряща (рис. 5). В проведенных исследованиях наблюдалось увеличение интенсивности окрашивания альциановым синим в дифференцированных клетках по сравнению с контролем. Накопление глюкозамингликанов говорит о синтезе основных структурных компонентов суставного матрикса.
Известно, что клеи с различными пропорциями и количествами тромбина и фибриногена по-разному влияют на МСК. Так, например, в зависимости от состава, фибриновый клей может или усиливать пролиферацию, или ускорять дифференцировку в нейрогенном направлении МСК из зубной пульпы (Germain et al., 2015). Дальнейшие более детальные исследования необходимы для выяснения вопроса о влиянии состава фибринового клея на пролиферативную активность и способность к дифференцировке в хондрогенном направлении.
Выводы:
- Плазма пуповинной крови является удобным источником фибриногена для получения фибринового клея.
- Фибриновый клей на основе пуповинной крови пригоден для культивирования МСК.
- Применение фибринового клея на основе пуповинной и периферической крови в качестве скаффолда не приводит к снижению пролиферативного и дифференцировочного потенциала МСК, а также к изменению их иммунофенотипа.
- МСК из фибринового клея сохраняют способность дифференцироваться в хондрогенном направлении.
- Дифференцированные МСК в хондрогенном направлении начинают экспрессировать гликозамингликаны, характерные для суставного матрикса.
- Фибриновый клей на основе пуповинной крови может использоваться в качестве скаффолда для регенеративной терапии хрящевых тканей.
Список литературы:
- Pittenger MF Multilineage potential of adult human mesenchymal stem cells / Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR // Science. -1999. -284(5411). – P. 143-7.
- Barry FP Mesenchymal stem cells: clinical applications and biological characterization / Barry FP, Murphy JM // Int J Biochem Cell Biol. -2004. – Vol. 36. — Issue 4. – P. 568–584.
- Heng BC Directing stem cell differentiation into the chondrogenic lineage in vitro / Heng BC [et al] //Stem Cells. -2004. -Vol. 22(7). -P1152-67.
- Solchaga LA Chondrogenic differentiation of bone marrow-derived mesenchymal stem cells: tips and tricks / Solchaga LA1, Penick KJ, Welter JF // Methods Mol Biol. -2011. –Vol. 698. –P. 253-278.
- Wagner W Comparative characteristics of mesenchymal stem cells from human bone marrow, adipose tissue, and umbilical cord blood / Wagner W [et al] // Exp Hematol. -2005. –Vol. 33(11). –P. 1402-1416.
- Jin HJ Comparative analysis of human mesenchymal stem cells from bone marrow, adipose tissue, and umbilical cord blood as sources of cell therapy /Jin HJ [et al] // Int J Mol Sci. -2013. -Vol. 3;14(9). –P. 17986-8001.
- Айзенштадт АА Сравнение пролиферативной активности и фенотипа МСК, полученных из костного мозга, жировой ткани и пупочного канатика / Айзенштадт А.А [и др]// Вестник Северо-западного государственного медицинского университета им.И.И.Мечникова, 2015.-N 2.-С.14-22
- Slaughter BV Hydrogels in regenerative medicine/ Slaughter [et al]// Adv Mater. -2009. –Vol. 21(32-33) –P. 3307-29.
- Jockenhoevel S Fibrin gel — advantages of a new scaffold in cardiovascular tissue engineering/ Jockenhoevel S [et al]// Eur J Cardiothorac Surg. -2001. –Vol. 4 -P. 424-30.
- Swartz DD Engineering of fibrin-based functional and implantable small-diameter blood vessels/ Swartz DD [et al]// Am J Physiol Heart Circ Physiol. -2005. –Vol. 288(3). –P. 1451-60.
- Ahmed TA Fibrin: a versatile scaffold for tissue engineering applications// Ahmed TA [et al]// Tissue Eng Part B Rev. -2008. –Vol. 14(2) –P. 199-215.
- Phadnis SM Human umbilical cord blood serum promotes growth, proliferation, as well as differentiation of human bone marrow-derived progenitor cells/ Phadnis SM [et al]// In Vitro Cell Dev Biol Anim. – 2006. — Vol.42(10). – P. 283-286.
- Tekkatte С «Humanized» stem cell culture techniques: the animal serum controversy/ Tekkatte C [et al]// Stem Cells Int. -2011.-Vol. 2011. –P. 504723.
- Pereira T (2014) MSCs Conditioned Media and Umbilical Cord Blood Plasma Metabolomics and Composition. / Pereira T [et al.]// PLoS ONE. – 2014 – Vol. 9(11):- e113769.
- Wiedemann M. Neonatal blood plasma is less susceptible to oxidation than adult plasma owing to its higher content of bilirubin and lower content of oxidizable Fatty acids./ Wiedemann M [et al]// Pediatr Res. – 2003 — Vol. 53(5) – P. 843-849
- Teger-Nilsson A.-C. Fibrinogen to fibrin transformation in umbilical cord blood and purified neonatal fibrinogen./ Teger-Nilsson A.-C. [et al]// Thromb Res.- 1974 – Vol. 5(5) – P. 601-612.
- Foley ME Viscosity, haematocrit, fibrinogen and plasma proteins in maternal and cord blood/ Foley ME [et al]//Br J Obstet Gynaecol. -1978. –Vol. 85(7). –P. 500-4.
- Mosesson MW The ultrastructure of fibrinogen-420 and the fibrin-420 clot./ Mosessen MW [et al.]// Biophysical Chemistry – 2004 – Vol.112 – P. 209– 214
- Hamulyak K. Reevaluation of some properties of fibrinogen, purified from cord blood of normal newborns/ Hmulyak K [et al]//Thromb Res. -1983. –Vol.32(3). –P. 301-10.
- Pool JG Experiences in the preparation of AHG concentrates from human plasma./ Pool JG, Hink JH// Bibl Haematol. – 1964 – Vol. 19 – P. 146-50
- Brecher M. America Association of Blood Banks Technical Manual. Methods 6.11, 6.12 / Brecher M.. / AABB, 15th Edition — 2005. – Chapter 3. – P. 814-15.
- Момот А.П. Патология гемостаза. Принципы и алгоритмы клинико-лабораторной диагностики/ Момот А.П.// С-Пб., ФормаТ -2006. -Стр. 208.
- Radosevich M Fibrin sealant: Scientific rationale, production methods, properties, and current clinical/ Radosevich [et al]// Vox Sang. – 1997 – Vol.72 – P. 133-143
- Lee OK Fibrin glue as a vehicle for mesenchymal stem cell delivery in bone regeneration/ Lee OK [et al]// J Chin Med Assoc. – 2008. –Vol. 71(2). –P. 59-61
- Ho W. The Behavior of Human Mesenchymal Stem Cells in 3D Fibrin Clots: Dependence on Fibrinogen Concentration and Clot Structure Tissue Engineering./ Ho [et al] -2006. –Vol. 12(6) –P. 1587
- Isogai N Experimental use of fibrin glue to induce site-directed osteogenesis from cultured periosteal cells// Isogai N [et al]// Plast Reconstr Surg. -2000. –Vol.105(3). –P. 953-63.
- Wu X Fibrin glue as the cell-delivery vehicle for mesenchymal stromal cells in regenerative medicine/ Wu X [et al]// The Journal of Cell Therapy. Cytotherapy -2012. –Vol. 14(5). –P. 555-562.
- Wang K Fibrin glue with autogenic bone marrow mesenchymal stem cells for urethral injury repair in rabbit model / Wang K[et al]// Tissue Eng Part A. -2012. –Vol. 18(23-24). –P. 2507-17
- Scotti C Engineering human cell-based, functionally integrated osteochondral grafts by biological bonding of engineered cartilage tissues to bony scaffolds/Scotti C [et al]// Biomaterials. -2010. -Vol. 31(8). –P. 2252-9
- Germain L Fibrin hydrogels to deliver dental stem cells of the apical papilla for regenerative medicine/Germain L [et al]// Regen Med. -2015. –Vol. 10(2). –P. 153-67.

