Применение клеточных технологий для восстановления процесса регенерации у людей старших возрастных групп
А.В. Печерский¹, В.И. Печерский¹, А.Б. Смолянинов², В.Н. Вилъянинов³, Ш.Ф. Адылов², В.Ф. Семиглазов⁴
- 1. Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия;
- 2. Покровский банк стволовых клеток, Санкт-Петербург, Россия;
- 3. Центр крови и тканей Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург, Россия;
- 4. НИИ онкологии им. профессора Н.Н. Петрова, Санкт-Петербург, Россия.
2014 год
Статья посвящена актуальной теме — восстановлению процесса регенерации у людей старших возрастных групп. Коммитированные клетки-предшественники и дифференцированные клетки могут делиться ограниченное число раз и не в состоянии обеспечить регенерацию тканей на протяжении всего онтогенеза. Обновление тканей на протяжении такого длительного периода невозможно без участия специализированной системы, ответственной за регенерацию. Данная система представлена шгорипотентными стволовыми клетками, которые способны дифференцироваться во все типы соматических клеток и в линию половых клеток, а также обладают способностью к самообновлению на протяжении всей жизни организма. Результаты исследования позволяют считать, что численность пула плюрипотентных стволовых клеток у людей старших возрастных групп можно восстановить путем трансфузии мононуклеарной фракции периферической крови от молодых доноров 18-23 лет одних с реципиентом групп крови и пола (патент РФ № 2350340).
После 40 лет у людей наблюдается снижение пула плюрипотентных стволовых клеток [1], приводящее к атрофии и фиброзным изменениям во всех тканях и органах. В частности, у мужчин отмечается атрофия яичек, проявляющаяся развитием фиброза базальной мембраны канальцев, уменьшением количества клеток Лейдига и другими изменениями. Примерно одинаковая скорость снижения численности пула плюрипотентных стволовых клеток у людей с увеличением возраста определяет одинаковую интенсивность склерозирования у них большинства тканей, составляющую около 1% в год после 35-40 лет [2,3]. Склерозирование тканей яичек у мужчин старше 35-40 лет приводит к уменьшению численности клеток Лейдига и последующему прогрессирующему снижению продукции тестостерона примерно на 1 % в год [3]. Последнее было названо частичным возрастным андрогенным дефицитом (Partial androgen defishency of aging men / PADAM) [4, 5].
Цель исследования — восстановление процесса регенерации у людей старших возрастных групп.
Материалы и методы
Пациенту 60-ти лет врачами-трансфузиологами Покровского банка стволовых клеток (Санкт-Петербург) проводилась регенеративная терапия в целях восстановления процесса обновления тканей (восстановления регенерации). Было проведено 7 переливаний мононуклеарной фракции периферической крови с промежутками в 2-3 месяца между ними. Заготовка мононуклеарной фракции периферической крови производилась от одного молодого донора 20 лет с одинаковыми с реципиентом полом (мужской пол) и антигенными системами: AB0, Rh-фактор, фенотип Rh-фактора, Kell (патент РФ № 2350340). Заготовка мононуклеарной фракции периферической крови от донора производилась на сепараторе клеток крови Amicus с использованием специализированной одноразовой стерильной расходной системы Амикус MNC-Кит. При первом переливании с целью формирования химеризма для минимизации антигенной нагрузки производился редуцированный забор мононуклеарной фракции периферической крови — 5 циклов сепарации (ориентировочный объем интраоперационно обработанной крови донора — 1500 мл). Для последующих переливаний, осуществляемых с целью восстановления обновления тканей (восстановления регенерации), мононуклеарная фракция периферической крови получалась путем проведения 15 циклов сепарации при аппаратной обработке 4600 + 100 мл крови донора. Перед забором мононуклеарной фракции периферической крови донор проходил стандартное обследование. В течение 5 дней до проведения операции донорского лейкоцитофереза производилась подготовка донора, включавшая подкожное введение филгастрима (фирменное название — нейпомакс) 78 млн ЕД /30 + 48 млн ЕД (780 мкг / 300 + 480 мкг) один раз в день, ежедневно. Последнее введение филгастрима производилось в день сепарации. В конце переливания мононуклеарной фракции периферической крови пациенту внутривенно однократно вводился преднизолон в дозе 50 мг для уменьшения выраженности посттрансфузионных реакций. Начиная с первых часов после переливания, пациенту вводился филгастрим (нейпомакс) 78 млн ЕД /30 + 48 млн ЕД (780 мкг / 300 + 480 мкг) один раз в день, ежедневно в течение 10 дней. Введение колониестимулирующего фактора (филгастрима) проводилось с целью преодоления перелитыми мононуклеарными лейкоцитами точки рестрикции при их попадании в чужеродную среду крови реципиента, а также для последующей стимуляции их деления и увеличения их числа. Дополнительно с этой же целью пациенту назначался метилурацил 0,5 по 1 таблетке четыре раза в день в течение 1 месяца. До начала регенеративной терапии и на её фоне пациенту по поводу частичного возрастного андрогенного дефицита проводилась андроген-заместительная терапия с индивидуально подобранной дозой препарата тестостерона — 1,6 мл 1% андрогеля в сутки, который наносился однократно утром на кожу живота. После 4-го введения мононуклеарной фракции периферической крови (по мере восстановления обновления тканей, которое сопровождалось увеличением уровня общего тестостерона) у пациента доза 1% андрогеля была уменьшена до 0,5 мл в сутки.
Определение гемопоэтических клеток-предшественников (ГКП) CD34+ периферической крови проводилось методом проточной цитометрии на проточном цитометре FC500 с использованием набора Stem-Kit Reagents, Beckman Coulter Company, Франция. Чувствительность метода определения концентрации гемопоэтических клеток-предшественников (ГКП) CD34+ периферической крови составила 0,5 кл/мкл. Коэффициент вариации составил 10,7%. Определение общего тестостерона и общего PSA проводилось иммуноферментным способом. Венозную кровь брали утром натощак в фиксированное время (8.00 — 10.00). Определение концентрации общего тестостерона и общего PSA проводилось наборами DPC (США). Чувствительность метода и коэффициент вариации составили для общего тестостерона — 0,02 нмоль/л и 8%, для общего PSA -0,01 нг/мл и 8%.
Результаты и их обсуждение
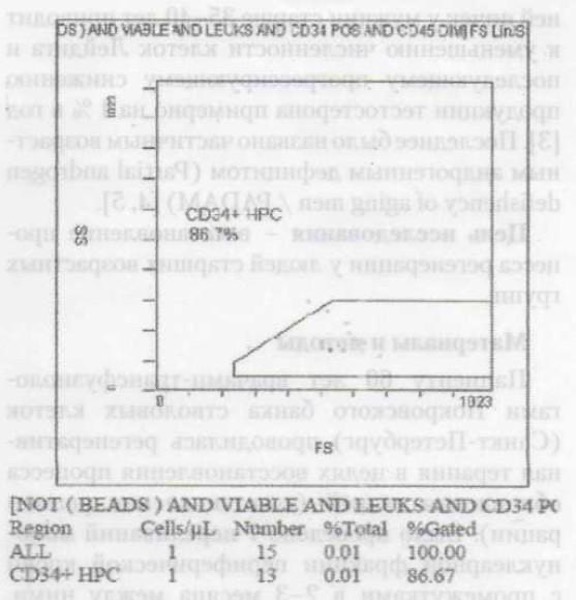
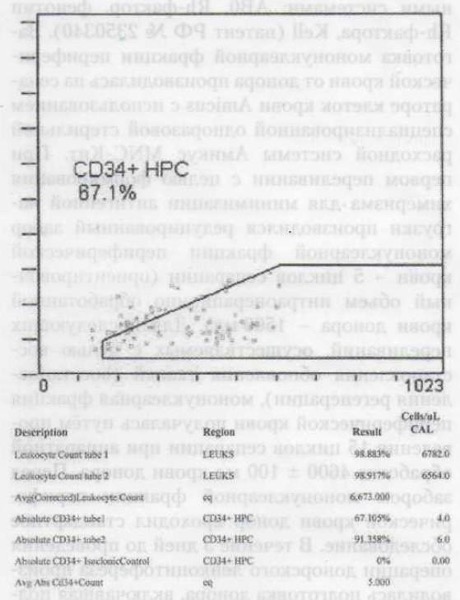
Через три месяца после седьмого переливания мононуклеарной фракции периферической крови содержание гемопоэтических клеток-предшественников (ГКП) CD34+ периферической крови увеличилось в 5 раз (с 1 до 5 клеток в 1 мкл). Сравнение полученного результата с данными 117 здоровых лиц разных возрастных групп с максимальным значением CD34+ периферической крови у молодых людей — 6,5 кл/мкл и минимальным значением у лиц более старшего возраста — 0,5 кл/мкл показало, что у пациента после завершения курса переливаний мононуклеарной фракции периферической крови от 20-летнего донора содержание CD34+ периферической крови приблизилось к максимальному значению, характерному для молодых лиц. Таким образом, у 60-летнего пациента удалось восстановить процесс регенерации до уровня молодых лиц. При этом СОЭ у наблюдаемого пациента после седьмой трансфузии уменьшилась с начальных 6 мм/час до 3 мм/час (табл. 1, рис. 1,2,3).
Показатели | Переливания мононуклеарной фракции периферической крови | |
|---|---|---|
До переливания | Через 3 мес. после 7-го переливания | |
Гемопоэтические клетки-предшественники (ГКП) CD34+, кл/мкл | 1 | 5 |
СОЭ, мм/час | 6 | 3 |
Таблица 1. Изменение содержания гемопоэтических клеток-предшественников (ГКП) в периферической крови при переливании пациенту 60 лет мононуклеарной фракции периферической крови от донора 20 лет | ||

После четвёртого переливания мононуклеарной фракции периферической крови у пациента наблюдалось увеличение содержания общего тестостерона, что позволило внести изменения в проводимую андроген-заместительную терапию — уменьшить дозу 1% андрогеля с 1,6 мл в сутки до 0,5 мл в сутки. После уменьшения дозы 1% андрогеля содержание общего тестостерона снизилось до прежнего достаточного уровня (табл. 2).
Значения общего PSA оставались нормальными. После седьмого переливания мононуклеарной фракции периферической крови по причине нормализации продукции тестостерона восстановленным числом собственных клеток Лейдига планируется отмена андроген-заместительной терапии.
У позвоночных большинство популяций дифференцированных клеток подвержены обновлению — непрерывно происходит гибель старых клеток и их замещение новыми клетками. В некоторых случаях новые дифференцированные клетки взрослого организма могут образовываться простым удвоением, при котором образуются две дочерние клетки того же типа (например, гепатоциты). В ряде тканей конечное состояние дифференцировки несовместимо с клеточным делением. Обновление клеток в таких тканях может происходить за счет клеток камбиальной зоны (например, базальные клетки эпидермиса, сперматогонии). Камбиальные клетки представляют собой специализированные клетки-предшественницы, которые могут делиться, но уже проявляют начальные признаки дифференцировки. При делении они дают потомство, часть которого продолжает дифференцировку, а часть остаётся низкодифференцированным [6].
Коммитированные клетки-предшественники и дифференцированные клетки, вступив на путь дифференцировки или завершив его, могут делиться ограниченное число раз [6] и не в состоянии обеспечить регенерацию ткани на протяжении всего онтогенеза. Обновление тканей на протяжении такого длительного периода невозможно без участия специализированной системы, ответственной за регенерацию. Данная система представлена плюрипотентными стволовыми клетками, которые способны дифференцироваться во все типы соматических клеток и в линию половых клеток, а также обладают способностью к самообновлению на протяжении всей жизни организма. Популяция плюрипотентных стволовых клеток неоднородна: при преимущественной локализации плюрипотентных стволовых клеток в костном мозге, клетки с подобными характеристиками обнаруживаются по данным ряда авторов [1, 7, 8] и в других производных мезодермы: в жировой ткани, в мышцах, в сердце и в дерме. Такая пространственная организация системы позволяет ей наиболее эффективно обеспечивать процессы регенерации тканей, а также предоставляет возможность взаимодополнения и взаимозамещения отдельных её составляющих.
Данная структура имеет характерные для системы механизмы саморегуляции. Число плюрипотентных стволовых клеток и камбиальных клеток-предшественников, а также их соотношение с дифференцированными клетками регулируется макроорганизмом. Соотношение данных клеток определяется конкретными задачами репарации. Плюрипотентные стволовые клетки являются отдельной ветвью дифференцировки эмбриональных клеток [6].
Показатели | Переливания мононуклеарной фракции периферической крови | ||
|---|---|---|---|
До переливания | после 4 переливаний | после 5 переливаний | |
Общий тестостерон, нмоль/л | 13,5 | 26,6 | 17,6 |
PSA общий, нг/мл | 1,27 | 1,60 | 1,16 |
Доза 1% андрогеля, мл | 1,6 | 1,6 | 0,5 |
Таблица 2. Изменение уровня общего тестостерона у пациента 60 лет при проведении переливаний мононуклеарной фракции периферической крови от донора 20 лет | |||
Учитывая, что в эксперименте диссоциированные клетки легче агрегируются с аналогичными клетками [6], донорские плюрипотентные стволовые клетки в большей степени агрегируются с плюрипотентными стволовыми клетками костного мозга с образованием колоний в нём. Последующая дифференцировка плюрипотентных стволовых клеток в клетки камбиальной зоны с пополнением их состава и последующая дифференцировка последних способствует замене погибших старых клеток. Универсальность механизма регенерации, осуществляемого посредством плюрипотентных стволовых клеток, было подтверждено ранее выявленным постепенным замещением клеток реципиента клетками донора после трансплантации стволовых клеток периферической крови [3].
Формирование и регенерация тканей, осуществляемые путём миграции клеток, представляют собой более сложный механизм по сравнению с их делением [6]. У старых клеток вследствие десиалирования клеточной поверхности нарушается защита концевых углеводных остатков мембранных гликоконъюгатов — на их поверхности появляется свободная манноза. Данные клетки становятся доступными для распознавания. При контакте макрофагов со старыми клетками происходит их активация и включение первой линии иммунной защиты — реакций естественного иммунитета [9]. Некроз или апоптоз и последующий лизис клетки сопровождаются развитием демаркационного воспаления. Некротические процессы (некроз, апоптоз) происходят на протяжении всего онтогенеза как проявление нормальной жизнедеятельности организма. В организме постоянно происходят гибель и разрушение старых клеток с последующей регенерацией, что и обеспечивает нормальную его жизнедеятельность [9, 10].
Продуктами инкреции макрофагов, активированных Т-клеток, а также эпителиальных и эндотелиальных клеток, клеток стромы кроветворных и лимфоидных органов, образующихся при воспалении, являются клеточные факторы роста, колониестимулирующие и хемотаксические факторы, а также интерлейкины [9]. При некрозе (или апоптозе) специфическая комбинация образующихся клеточных ростовых факторов способствует пролиферации и дифференцировке клеток-предшественниц, пролиферации фибробластов. Образование колониестимулирующих факторов способствует пролиферации стволовых клеток для их последующего поступления в камбиальные зоны или непосредственно в места гибели клеток. Инкреция клеточных ростовых факторов и колониестимулирующих факторов продолжается до полного восстановления поврежденной ткани [9].
Направленная миграция плюрипотентных стволовых клеток невозможна без образования специфических хеморецепторов. Их появлению должны предшествовать ряд промежуточных этапов. Первоначально необходимо связывание и доставка антигенов в лимфатические узлы или иные лимфоидные органы антиген-представляющими клетками, которые активизируются в ответ на десиалирование старых и интенсивно пролиферирующих клеток с появлением на их поверхности гликопротеинов, содержащих концевую маннозу.
Активация плюрипотентных стволовых клеток с образованием у них комплементарных рецепторов осуществляется через посредничество антиген-представляющих клеток. Антиген-представляющие клетки во вторичных лимфоидных органах встречаются с лимфоцитами. Лимфоциты попадают в лимфатические узлы из посткапиллярных венул, прикрепляясь к эндотелиальным клеткам и протискиваясь между ними. Затем они мигрируют в лимфатические сосуды, по которым поступают в лимфатические узлы [6]. Такая постоянная циркуляция позволяет обеспечить опосредованные антиген-представляющими клетками контакты Т-хелперов не только с Т-киллерами [9], но и с плюрипотентными стволовыми клетками с формированием у них соответствующих рецепторов [3].
Вероятность встречи Т-хелперов и плюрипотентных стволовых клеток (при их постоянной циркуляции через вторичные лимфоидные органы) с антиген-представляющими клетками значительно выше, по сравнению с возможностью возникновения контакта между ними самими. По аналогии с процессом активации цитотоксических Т-клеток, следующим этапом должно быть оказание Т-хелперами (через Т-клеточный рецептор и молекулу МНС II класса с презентуемым антигеном) активирующего действия на антиген-представляющие клетки. Активированные антиген-представляющие клетки через молекулу МНС II класса с антигеном (по аналогии с взаимодействием с Т-клеточным рецептором цитотоксической Т-клетки) связываются с плюприпотентными стволовыми клетками с последующим образованием тканеспецифических рецепторов на их поверхности. Появление тканеспецифичных рецепторов определяет пути миграции лимфоцитов [9] и стволовых клеток [3] к местам воспаления, включая места гибели старых клеток.
Активирование Т-хелперами (Th1) (при посредничестве антиген-представляющих клеток) цитотоксических Т-клеток сопровождается паракринным и аутокринным образованием IL-2. Среди прочих функций, 11-2 способен предохранять активированные клетки от апоптоза. Соответственно, у активированных Т-киллеров появляется экспрессия гена bcl-2 и некоторых других подобных генов [9]. Аналогичным образом экспрессия гена bcl-2 позволяет предотвратить развитие апоптоза у мигрирующих в область регенерации после опосредованного антиген-представляющими клетками контакта с Т-хелперами стволовых клеток. Дополнительное усиление экспрессии гена bcl-2 у коммитированных стволовых клеток происходит при их миграции в межклеточное пространство между эндотелиальными клетками, продуцирующими IL-7. Экспрессия гена bcl-2 позволяет высокочувствительным к неблагоприятным условиям среды стволовым клеткам выжить в условиях воздействия высокоактивных продуктов (активные формы азота и кислорода, TNFа, INF-у и другие), образующихся, в частности, при гибели старых клеток и развитии сопутствующего воспаления.
Образование хемоаттрактантов (в числе которых выступают антигены MHC I класса) и формирование у плюрипотентных стволовых клеток комплементарных им рецепторов (через представление аутоантигенов молекулами MHC II класса), представляется наиболее подходящим объяснением направленной миграции плюрипотентных стволовых клеток к определенным погибшим клеткам определённых тканей [3].
Участие плюрипотентных стволовых клеток и возможное посредничество антиген-представляющих клеток, Т-хелперов/Т-супрессоров в комплексе с молекулами MHC I класса/II класса позволяют предполагать, что именно иммунная система ответственна за регенерацию тканей организма. Значительное преобладание аутоантигенов (99%) среди пептидов, представляемых молекулами MHC II класса, а также существенное преобладание субпопуляции CD4+-лимфоцитов (хелперов) над CD8+-киллерами в крови и в лимфе показывает, что участие в процессах регенерации является важнейшей (а может быть и ведущей) функцией иммунной системы [3].
Заселение тимуса стволовыми клетками необходимо не только для последующего образования Т-клеток, но и для поддержания нормального функционального состояния эпителия тимуса — для формирования эпителиального ретикулума и кортико-медуллярной структуры тимуса в онтогенезе [9]. Эпителиальные клетки тимуса составляют микроокружение развивающихся тимоцитов и служат источниками сигналов, генерируемых при прямых клеточных контактах. В процессе данных контактов клетки микроокружения тимуса передают Т-лимфоцитам информацию об антигенах собственных тканей, а также, по-видимому, формируют у них тип ответных реакций на презентуемые антигены [9]. Активация Т-киллеров происходит в ответ на презентацию антигенов пораженной вирусом клетки или чужеродной ткани [9]. Напротив, презентация аутоантигенов погибших старых клеток приводит к последующей активации плюрипотентных стволовых клеток с образованием у них тканеспецифичных рецепторов (определяющих их направленную миграцию) и восстановлению соответствующих тканей [3].
При переливании аллогенных плюрипотентных стволовых клеток эпителиальные клетки микроокружения тимуса будут формироваться, в том числе, и из донорских клеток. Соответственно, в процессе обучения Т-лимфоциты дополнительно начнут воспринимать в качестве «своих» антигены донора. Данная закономерность, по-видимому, определяет развитие иммунологической толерантности, развивающейся, по данным ряда авторов, при трансплантации тканей или органов после предварительного переливания крови (плюрипотентных стволовых клеток/костного мозга) от единого донора, а также после предварительной трансплантации клеток зародыша в эксперименте [6]. Переливание стволовых клеток периферической крови / костного мозга приводит к формированию химерной особи. Данная особь приобретает два типа плюрипотентных стволовых клеток с двумя различными генотипами. Последующая миграция стволовых клеток двух видов в тимус и обновление его собственных клеток микроокружения приводит к формированию Т-лимфоцитов, воспринимающих антигены собственного организма и антигены донора как «свои». Данное заключение было подтверждено ранее выполненным исследованием, выявившим отсутствие реакции отторжения у пациентов через 1 год после пересадки стволовых клеток периферической крови на клетки буккального эпителия, в 50-100% случаев имевшие генотип донора [3]. Теоретически химерному реципиенту могут быть пересажены от донора стволовых клеток любые ткани или органы без риска последующего отторжения. Закономерно в представленном клиническом случае на фоне множественных трансфузий мононуклеарной фракции периферической крови от одного молодого донора (при соответствии группы крови и пола) у пациента не отмечалось реакции иммунной системы. В частности, у пациента не было повышения СОЭ. Напротив, СОЭ имело тенденцию к снижению, поскольку на фоне восстановления процесса обновления тканей снижалась стимуляция митогенной активности, что, соответственно, приводило к снижению реакции иммунной системы на избыточно пролиферирующие клетки. На фоне химеризма и сопутствующей ему иммунологической толерантности наблюдалось увеличение числа гемопоэтических клеток предшественников СD34+ в периферической крови реципиента. Данный эффект был обусловлен дифференцировкой СD34+ из обладающих большим пролиферативным потенциалом клеток мононуклеарной фракции молодого донора, которые образовали колонии в костном мозге реципиента (табл. 1, рис. 2, 3).
Представление о бессмертии плюрипотентной стволовой клетки — её способности к неограниченному числу делений — является в определенной степени условным. Пролиферативное поведение клеток на протяжении онтогенеза управляется долговременными внутриклеточными программами. Взаимоотношения между долговременными и кратковременными механизмами контроля определяются, по-видимому, программой развития, реализуемой через клеточные факторы роста, колониестимулирующие факторы, продукты, образованные при экспрессии протоонкогенов и другие факторы [6]. С возрастом количество клеток, которые по данным маркирования могут быть отнесены к плюрипотентным стволовым клеткам, постепенно уменьшается [1]. Для поддержания нормального состояния в организме каждую секунду должно образовываться несколько миллионов новых клеток [6]. Одновременно каждую секунду происходит некроз (или апоптоз) такого же количества старых клеток, приводящий к множеству локальных участков воспаления. У лиц старших возрастных групп некротизированные старые клетки не возмещаются адекватным количеством низкодифференцированных клеток-предшественников (или стволовых клеток), что делает невозможным завершение процесса регенерации. Учитывая, что плотность клеточной популяции обратно пропорциональна концентрации факторов роста в среде, у данной категории лиц при незавершенном процессе регенерации в местах гибели старых клеток и обеднении камбиальных зон из-за сокращения численности пула стволовых клеток компенсаторно увеличивается образование клеточных ростовых факторов (для стимуляции пролиферации низкодифференцированных клеток камбиальных зон), а также увеличивается образование колониестимулирующих факторов (для стимуляции пролиферации плюрипотентных стволовых клеток). Продукция данных факторов для оказания дополнительного стимулирующего воздействия на пролиферацию клеток усиливается. Повышенная продукция ростовых факторов у людей старших возрастных групп из-за сокращения пула стволовых клеток и обеднения камбиальных зон не приводит к образованию адекватного количества клеток-предшественников, обеспечивающих замену погибших старых клеток. Более того, с возрастом количество клеток камбиальных зон только уменьшается. Соответственно, данная стимуляция с увеличением возраста усиливается и становится постоянной. Данная избыточная стимуляция митогенной активности, наблюдаемая во всех тканях у людей старших возрастных групп, неотвратимо приводит к метаплазии, а затем к малигнизации. Последняя может наступить раньше при наличии предрасполагающих наследственных факторов и при местном действии канцерогенных факторов (как внешних, так и внутренних, образующихся, например, при хроническом воспалении), которые способны ускорить наступление злокачественной трансформации определённой ткани [3].
В условиях преобладания гибели старых клеток над процессами регенерации у лиц старших возрастных групп, по-видимому, стимулируется образование как плюрипотентных стволовых клеток костного мозга, так и образование стволовых клеток жировой и некоторых других видов тканей. Вовлечение жировой ткани в процессы компенсации приводит к увеличению её массы [3,11].
При недостаточности количества плюрипотентных стволовых клеток и, соответственно, камбиальных клеток в области некроза (или апоптоза), при невозможности завершения регенерации данного участка ткани уровни клеточных ростовых факторов будут возрастать, вызывая интенсивную пролиферацию фибробластов. В данных условиях количество фибробластов будет значительно преобладать над количеством камбиальных клеток, приводя к образованию рубца. Соотношение камбиальных клеток и фибробластов определяет выраженность образования рубцовой ткани. При миграции адекватного числа стволовых клеток и формировании достаточного количества камбиальных клеток, по-видимому, участок некроза (или апоптоза) может полностью восстановиться без развития фиброзной ткани [3].
Возрастная инволюция тимуса сопровождается снижением его массы, а также замещением эпителиального компартмента соединительной тканью и производными фибробластов — адипоцитами. После 50-60 лет отмечается снижение количества Т-клеток (в большей степени Т-хелперов). Возрастное снижение Т-хелперов может негативно отразиться на формировании тканеспецифичных рецепторов плюрипотентных стволовых клеток и, соответственно, на процессе регенерации. Среди популяций тимоцитов наиболее сильно убывает численность их незрелых кортикальных форм — CD4+CD8+. Тем не менее, в тимус продолжают постоянно поступать костномозговые предшественники, из тимуса продолжают эмигрировать зрелые Т-клетки, хотя интенсивность этого процесса снижается [9]. Возрастное снижение плюрипотентных стволовых клеток негативно сказывается не только на заселении тимуса лимфоидными элементами, но и на поддержании нормального функционального состояния эпителия тимуса — на формировании эпителиального ретикулума и кортикомедуллярной структуры тимуса.
При частичном возрастном андрогенном дефиците нарушения развития андроген-зависимых клеток морфологически проявляются атрофией состоящих из них тканей [12, 13, 14, 15, 16]. Как показало ранее проведённое исследование [3], стволовые клетки периферической крови у мужчин имеют андрогенные рецепторы и, соответственно, являются андроген-зависимыми. Возрастное снижение продукции половых гормонов негативно сказывается на развитии и пролиферации зависимых от них плюрипотентных стволовых клеток, что является дополнительным негативным фактором, способствующим уменьшению их количества. Последующее нарушение регенерации тканей гонад (яичек у мужчин с уменьшением клеток Лейдига, инкретирующих тестостерон) свидетельствует о формировании порочного круга с феноменом взаимного отягощения [3].
Восстановление пула плюрипотентных стволовых клеток у лиц старших возрастных групп обеспечивает их достаточное поступление в камбиальные зоны с последующим возмещением старых некротизированных клеток адекватным количеством молодых коммитированных клеток. За этим следует обратное развитие описанных выше патологических процессов. Для обеспечения непрерывно происходящего процесса обновления тканей у лиц старших возрастных групп требуется постоянное поддержание нормальной численности пула плюрипотентных стволовых клеток [3].
Потенциальная возможность обновления эпителиальных клеток тимуса (осуществляющих обучение Т-лимфоцитов) перелитыми аллогенными плюрипотентными стволовыми клетками с последующим восприятием их тканеспецифичных антигенов иммунной системой реципиента как «своё» позволяет считать данный способ наиболее перспективным для нормализации численности пула плюрипотентных стволовых клеток у лиц старших возрастных групп. После переливания плюрипотентные стволовые клетки образуют свой пул, представленный их колониями в костном мозге реципиента, который принимает участие в обновлении подавляющего числа тканей организма. Индивидуум становится химерой. Ввиду распространенности химеризма в естественных условиях искусственное формирование химерной особи через переливание аллогенных плюрипотентных клеток может широко использоваться для восстановления регенерации у людей старших возрастных групп [3].
Эффективность восстановления регенерации при переливании аллогенных плюрипотентных стволовых клеток лицам старших возрастных групп будет зависеть от разницы между возрастом молодого донора и возрастом более старшего реципиента. В данном случае принципиальное значение имеет этап долгосрочной внутриклеточной программы, на котором находятся клетки донора и клетки реципиента. Наличие долгосрочных внутриклеточных программ плюрипотентных стволовых клеток, определяющих их пролиферативный потенциал (способность поддерживать необходимую численность собственного пула), существенно отличает плюрипотентные стволовые клетки молодых лиц от аналогичных клеток лиц старших возрастных групп. Восстановление пула плюрипотентных стволовых клеток у людей старших возрастных групп может быть достигнуто переливанием мононуклеарной фракции периферической крови. Первичное переливание стволовых клеток периферической крови не сопровождается ответом иммунной системы реципиента, поскольку у них подавлена экспрессия всех антигенов MHC I класса, за исключением HLA-G. Аналогичный эффект у стволовых клеток пуповинной крови (в дополнение к имеющемуся гематоплацентарному барьеру) позволяет предотвратить отторжение плода [6, 17]. Учитывая развитие иммунологической толерантности, обусловленной химеризмом, переливание стволовых клеток от одного донора может быть выполнено многократно до получения нормализации численности пула плюрипотентных стволовых клеток у пациента.
Несмотря на формирование химеризма и восприятие иммунной системой реципиента клеток донора как «своих», для макрофагов (нейтрофилов и других) переливаемой донорской мононуклеарной фракции периферической крови антигены реципиента остаются «чужими». Вероятно, с этим были связаны кратковременные посттрансфузионные реакции у реципиента, для уменьшения выраженности которых сразу после завершения трансфузии проводилось однократное введение преднизолона.
В представленном случае трансфузия мононуклеарной фракции периферической крови от 20-летнего донора позволила у 60-летнего реципиента в пять раз увеличить количество гемопоэтических клеток-предшественников (ГКП) периферической крови без реакции на донорские клетки со стороны иммунной системы реципиента. Показательным является сравнение полученного результата с ранее опубликованными данными обследования 117 здоровых лиц различных возрастных групп (табл. 1, рис. 1,2,3). При обследовании здоровых лиц было выявлено максимальное значение CD34+ периферической крови у молодых людей — 6,5 кл/мкл и минимальное значение — у лиц более старшего возраста — 0,5 кл/мкл. Сравнение количества CD34+ в периферической крови у наблюдавшегося пациента с данными контрольными значениями показывает, что у пациента после завершения курса из 7 переливаний мононуклеарной фракции периферической крови от 20-летнего донора содержание CD34+ периферической крови приблизилось к максимальному значению, которое характерно для молодых людей. Таким образом, переливание мононуклеарной фракции периферической крови от 20-летнего донора позволило у 60-летнего пациента восстановить процесс регенерации (табл. 1, рис. 1, 2, 3).
При существенной разнице в возрасте между молодым донором и реципиентом старших возрастных групп пролиферативный потенциал плюрипотентных стволовых клеток донора существенно превосходит аналогичный показатель реципиента. Это приводит к доминированию пула плюрипотентных стволовых клеток донора в ответ на образование колониестимулирующих факторов реципиента. Соответственно, обновление подавляющего числа клеток тканей реципиента осуществляется за счет перелитых и образовавших колонии в костном мозге плюрипотентных стволовых клеток донора. В данных условиях для уменьшения антигенной нагрузки оптимальным является использование для переливания плюрипотентных стволовых клеток от одного донора (или, что менее желательно, от ограниченного числа доноров) [3].
Участие перелитых плюрипотентных стволовых клеток в обновлении подавляющего числа тканей организма, включая ткани эндокринных органов, требует учета целого ряда факторов. Переливание стволовых клеток периферической крови от донора одного пола реципиенту противоположного пола может оказать негативное влияние на регуляцию половых гормонов. При увеличении образования гормонов противоположного пола повышается риск развития различных сердечно-сосудистых заболеваний. Соседство клеток от индивидуумов разных полов в одной ткани, вероятно, будет сопровождаться различными реакциями несовместимости. Реакции несовместимости будут развиваться также при переливании стволовых клеток периферической крови от донора реципиенту, имеющих различные группы крови. В частности, это будет происходить из-за дифференцировки части перелитых плюрипотентных стволовых клеток в клетки эритроидного ростка кроветворения с образованием из них эритроцитов, имеющих отличные от эритроцитов реципиента антигены [3].
Различия, связанные с полом и группами крови, появились на ранних этапах эволюции. Формирование всех регуляторных систем организма человека в процессе филогенеза происходило с учетом данных факторов. Так, антигены системы AB0 присутствуют не только на эритроцитах, но и на многих других клетках человека, а также экспрессируются большим числом микроорганизмов. Антигены системы AB0 локализованы в углеводной части гликопротеинов. Структура этих углеводов, как и углеводов, определяющих близкую систему групп крови — Льюис, зависит от экспрессии генов, определяющих активность ферментов, транспортирующих терминальные сахара при синтезе олигосахаридных молекул [17]. По этой причине переливание плюрипотентных стволовых клеток в составе стволовых клеток периферической крови или костного мозга, которые дифференцируются в том числе в клетки эритроидного ростка, должна осуществляться от донора реципиенту одного пола, имеющих одинаковые группы крови (патент РФ № 2350340). Благодаря соблюдению этих принципов, у представленного пациента реакций иммунной системы не наблюдалось (табл. 1).
Нарушение процесса обновления эндокринных органов приводит к развитию гормонального дисбаланса, оказывающего существенное влияние на факторы внеклеточной среды, ускоряющие клеточное старение. В частности, при возрастном снижении продукции тестостерона у мужчин наблюдается увеличение уровней таких индукторов апоптоза, как глюкокортикоиды, фактор некроза опухоли а (TNF-a), активные формы кислорода и азота [11, 18]. Для повышения эффективности переливания — для сохранения жизнеспособности перелитых плюрипотентных стволовых клеток — пациенты нуждаются в дополнительном назначении андроген-заместительной терапии в индивидуально подобранной дозе [19] до нормализации у них пула плюрипотентных стволовых клеток и восстановления собственной продукции тестостерона. Данное положение было также реализовано у представленного пациента (табл. 1, 2).
Параллельно с переливанием людям старших возрастных групп мононуклеарной фракции периферической крови от молодых доноров с постепенным восстановлением у них пула стволовых клеток возможна дополнительная стимуляция регенерации отдельных тканей с выраженными атрофическими и фиброзными изменениями. Например, для восстановления регенерации кожи пациенты могут быть направлены к косметологу для проведения различных видов пилинга или аппаратных методов восстановления кожи. Микротравматизация кожи, наносимая при проведении данных процедур, приводит к развитию асептического воспаления, подобного тому, которое возникает при гибели старых клеток [20]. Гибель клеток вызывает миграцию в места повреждения макрофагов, являющихся одновременно антиген-представляющими клетками. Происходит существенное увеличение доставляемых макрофагами к Т-хелперам аутоантигенов клеток кожи. В ответ на увеличение поступления тканеспецифичных аутоантигенов, не пораженных вирусами собственных клеток, Т-хелперы начинают формировать соответствующие им рецепторы у большего числа стволовых клеток, мигрирующих к местам альтерации, а также к другим участкам кожи, имеющим сходные тканеспецифичные антигены MHC I типа. Увеличение миграции стволовых клеток к коже при проведении пилинга или аппаратных процедур восстановления кожи у людей старших возрастных групп после трансфузий им мононуклеарной фракции периферической крови от молодых доноров не будет наносить ущерба регенерации других тканей благодаря достаточности восстановленного у них пула стволовых клеток, способного покрыть все возникающие потребности. Аналогичный дополнительный эффект стимуляции регенерации определённых тканей можно получить при назначении пациентам препаратов, полученных из аналогичных ксеногенных тканей, которые содержат общие с ними тканеспецифичные антигены.
Заключение
Плюрипотентные стволовые клетки являются универсальным механизмом регенерации, сформированным в процессе эволюции. Возрастное снижение количества плюрипотентных стволовых клеток нарушает процессы обновления тканей, включая ткани эндокринных органов. Развивающийся гормональный дисбаланс усугубляет происходящие изменения. Взаимное отягощение развивающихся патологических процессов приводит к формированию порочного круга. Соответственно, у людей старших возрастных групп повышается риск развития онкологических заболеваний, прогрессируют атрофические и склеротические процессы в подавляющем числе тканей, нарастают деструктивные изменения соединительной ткани (с уменьшением ее прочностных характеристик). Перспективным способом обратного развития данных патологических процессов может стать трансфузия аллогенных плюрипотентных стволовых клеток в составе мононуклеарной фракции периферической крови, заготовленной от молодых доноров (18-23 лет) с одинаковыми полом и группами крови с реципиентами. Количество необходимых трансфузий определяется наступлением восстановления у реципиентов численности пула стволовых клеток.
Литература
- Тепляшин, А.С. Характеристика мезенхимальных стволовых клеток человека, выделенных из костного мозга и жировой ткани / А.С. Тепляшин, С.В. Коржикова, С.З. Шарифуллина, Н.И. Чупикова, М.С. Ростовская, И.П. Савченкова // Цитология. — 2005. — Т. 47, № 2. — С. 130-135.
- Тареева, И.Е. Нефрология / И.Е. Тареева. — М.: Медицина, 1995. — Т. 1. — 496 с.
- Печерский, А.В. Некоторые аспекты процесса регенерации, осуществляемой посредством плюрипотентных стволовых клеток / А.В. Печерский, В.И. Печерский, М.В. Асеев, А.В. Дробленков, В.Ф. Семиглазов // Цитология. — 2008. — Т. 50, № 6. — С. 511-520.
- Bremner, W.J. Loss of circadian rhytmicity in blood testosterone levels with aging in normal men. / W.J. Bremner, M.V. Vitietto, P.N. Prinz // Clin. Metab. — 1983. — Vol. 56. P. 1278-1281.
- Gray, A. Age, disease, and changing sex-hormone levels in middle-aged men : Results of the Massachusetts male aging study / A. Gray, H.A. Feldman, J.B. McKinlay, C. Longcope // Clin. — 1991. — Vol.73, № 2. — P. 1016-1025.
- Alberts, B. Molecular biology of the cell / B. Alberts, D. Bray, J. Lewis, M. Raff, K. Roberts, J.D. Watson — Moscow:Mir, 1994. — T. 1. — 517 p., T. 2. — 539 p., T. 3. — 504 p.
- Toma, J.G. Isolation of multipotent adult stem cells from the dermis of mammalian skin/J.G. Toma, M. Akhavan, K.J. Fernandes, F. Barnabe-Heider, A. Sadikot, D.R. Kaplan, F.D. Miller // Nat. Cell Biol. — 2001. — Vol. 3. — P. 778-784.
- Zuk, P.A. Human adipose tissue is source of multipotent stem cells / P.A. Zuk, M. Zhu, P.Ashjian, D.A. De Ugarte, J.I. Fraser, P. Benhaim, M.H. Hedrick// Mol. Cell. — 2002. Vol.13. — P. 4279-4295.
- Ярилин, А.А. Основы иммунологии / А.А. Ярилин. — М.: Медицина, 1999. — 608 с.
- Струков, А.И. Патологическая анатомия / А.И. Струков, В.В. Серов. — М.: Медицина, 1993. — 688 с.
- Печерский, А.В. Влияние частичного возрастного андрогенного дефицита на развитие метаболического синдрома / А.В. Печерский, В.Ф. Семиглазов, В.И. Мазуров, А.И. Карпищенко, В.И. Печерский, Н.Н. Зыбина, Н.И. Давыдова, В.Ю. Кравцов, С.Н. Прошин, М.Г. Скоробогатых, О.Б. Лоран // Лабораторная диагностика. — 2006. — № 4. — С. 12-19.
- Лопаткин, НА. Руководство по урологии/ Н.А. Лопаткин. — М.: Медицина,. 1998. — Т. 3. — 672 с.
- Ryde, C.M. Steroid and growth factor modulation of aromatase activity in MCF7 and T 47D breast carcinoma cell lines / C. M. Ryde, J.E. Nicholls, M. Dowsett // Cancer Res. — 1992. — Vol. 52.-P. 1411-1415.
- Sporn, M.B. The waron cancer/M.B. Sporn // Lancet;. — 1996. — Vil. 347. — P. 1377-1381.
- Берштейн, Л.М. Гормональный канцерогенез / Л.М. Берштейн. — СПб.: Наука, 2000. — 200с.
- Печерский, А.В. Изменение экспрессии рецепторов стероидных гормонов при развитии частичного возрастного андрогенного дефицита (PADAM) / А.В. Печерский, В.Ф. Семиглазов, Б.К. Комяков, Б.Г Гулиев, А.И. Горелов, А.И. Новиков, В.И. Печерский, Н.Н. Симонов, А.В. Гуляев, И.А. Самусенко, М.С. Венский, А.Г. Миттенберг, О.Б. Лоран // Цитология. — 2005. — Т. 47, № 4. — С. 311-317.
- Roitt I. Immunology / I. Roitt, J. Brostoff, D. Male. — Moscow: Mir, 2000. — 582 p.
- Печерский, А.В. Изменение уровня цитокинов у пациентов с раком предстательной железы после орхиэктомии /А.В. Печерский, В.Ф. Семиглазов, О.Б. Лоран, В.И. Мазуров, В.Ф. Карпищенко, В.Ф. Никифоров, Н.М. Калинина, Л.Б. Дрыгина, Н.И. Давыдова, М.Г. Скоробогатых // TERRA MEDICA nova, специальный выпуск «Лабораторная диагностика». — 2003. — № 2. — С. 26-30.
- Печерский, А.В. К вопросу о диагностике и лечении частичного возрастного андрогенного дефицита / А.В. Печерский // Вестник Санкт-Петербургской медицинской академии последипломного образования. — 2010. — Т.2, № 4. — С. 30-37.
- Серов, В.В. Воспаление / В.В. Серов, В.С. Пауков. — М.: Медицина, 1995. — 640 с.

