NOTCH-зависимая активация остеогенного потенциала клеток периодонта
https://transmed.almazovcentre.ru/jour/article/view/523/0
Для цитирования:
Семенова Д.С., Костина А.С., Мустаева А.М., Клаузен П.Е., Добрынин М.А., Боярская Н.В., Домбровская Ю.А., Малашичева А.Б., Енукашвили Н.И. Notch-зависимая активация остеогенного потенциала клеток периодонта. Трансляционная медицина. 2020;7(2):21-32. https://doi.org/10.18705/2311-4495-2020-7-2-21-32
ISSN 2311-4495
ISSN 2410-5155 (Online)
УДК 581.17:616.31-002
NOTCH-зависимая активация остеогенного потенциала клеток периодонта
Семенова Д. С.1, 2, Костина А. С.1, 2, Мустаева А. М.3, Клаузен П. Е.1, Добрынин М. А.2, Боярская Н. В.5, Домбровская Ю. А.4, Малашичева А. Б.1, 2, Енукашвили Н. И.2, 4
1Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр имени В. А. Алмазова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия
2Федеральное государственное бюджетное учреждение науки Институт цитологии Российской академии наук, Санкт-Петербург, Россия
3Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный университет», Санкт-Петербург, Россия
4Федеральное государственное бюджетное образовательное учреждение высшего образования «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия
5Федеральное государственное бюджетное образовательное учреждение высшего образования «Российский государственный педагогический университет им. А. И. Герцена», Санкт-Петербург, Россия
Резюме
Актуальность и цель. Стволовые клетки периодонта — перспективный материал для стоматологии и челюстно-лицевой хирургии. Сигнальный путь Notch является одним из ключевых в отношении под держания стволовых и дифференцировочных свойств стволовых клеток. Целью данной работы было выяснить, каким образом сигнальный путь Notch влияет на остеогенный потенциал периодонтальных стволовых клеток (СК).
Материалы и методы. В работе использовали лентивирусную трансдукцию периодонтальных СК, добавляя различное количества вируса (1, 3, 5, 15 MOI), несущего последователь ность, кодирующую активированный внутриклеточный домен рецептора Notch1 — NICD. С помощью метода ПЦР в реальном времени анализировали изменения уровней экспрессии остеогенных маркеров (RUNX2, COL1A1, OGN, POSTN) в зависимости от силы активации сигнального пути Notch. Мы опреде ляли степень активации Notch, детектируя уровень экспрессии гена-мишени — HEY1 — через 48 и 120 часов после индукции остеогенной дифференцировки. Используя методику экстракции красителя али заринового красного, проводили количественную оценку интенсивности минерализации культур пери одонтальных СК на финальной стадии остеогенной дифференцировки.
Результаты. Установлено, что активация сигнального пути Notch ведет к усилению экспрессии остеогенных маркеров уже на ранних этапах индукции остеогенной дифференцировки, что, в свою очередь, приводит к развитию финаль ной стадии остеогенной дифференцировки, характеризующейся формированием кальцификатов. Более того, чем большее количество лентивирусных частиц было использовано при трансдукции клеток, тем, соответственно, интенсивнее был изначальный запуск Notch, и в ответ на это мы отмечали более эф фективное прохождение процессов остеогенной дифференцировки клеток.
Заключение. Активация сигнального пути Notch приводит к повышению остеогенного потенциала периодонтальных СК дозоза висимым образом и индуцирует в клетках процессы, связанные с накоплением кальцификатов, интенсив ность образования которых напрямую зависит от «силы сигнала» Notch. Полученные в данной работе ре зультаты убеждают в том, что Notch способен модулировать остеогенную дифференцировку, влияя на ее эффективность, по-видимому, за счет интенсивности сигнала, передающегося от одной клетки к другой.
Ключевые слова: остеогенная дифференцировка, периодонтальные стволовые клетки, сигнальный путь Notch.
Для цитирования: Семенова Д.С., Костина А.С., Мустаева А.М. и др. Notch-зависимая актива ция остеогенного потенциала клеток периодонта. Трансляционная медицина. 2020;7(2): 21–32. DOI: 10.18705/2311-4495-2020-7-2-21-32.
NOTCH-dependet activation of periodontal cells osteogenic potential
Semenova D. S.1, 2, Kostina A. S.1, 2, Mustaeva A. M.1, 3, Klauzen P. E.1, Dobrynin M. A.2, Boyarskaya N. V.5, Dombrovskaya Yu. A.4, Malashicheva A. B.1, 2, Enukashvily N. I.2, 4
1Almazov National Medical Research Centre, Saint Petersburg, Russia 2Institute of Cytology of the Russian Academy of Science, Saint Petersburg, Russia
3Saint Petersburg State University, Saint Petersburg, Russia
4North-Western State Medical University named after I. I. Mechnikov, Saint Petersburg, Russia
5The Herzen State Pedagogical University of Russia, Saint Petersburg, Russia
Abstract
Background and objective. Periodontal stem cells are a promising material for dentistry and maxillofa cial surgery. In this work, we sought to find out how Notch signaling pathway affects the osteogenic potential of periodontal ligament stem cells (PDLSC).
Design and methods. In order to verify this, we used lentiviral transduction of PDLSC, adding various amounts of the virus bearing the activated intracellular domain of the Notch1 receptor, NICD. Using real-time PCR, we analyzed the dependence of changes in the expression levels of osteo-markers (RUNX2, COL1A1, OGN, POSTN) on the activation strength of Notch signaling pathway, based on the expression of the target gene — HEY1, in the early stages of differentiation, after 48 and 120 hours after induction of osteogenic differentiation. In addition, using the technique of Alizarin red extraction, we were able to quantify the intensity of mineralization of periodontal MSCs at the final stage of osteogenic differentiation.
Results. We found that activation of Notch signaling pathway leads to increased expression of osteogenic mark ers in the early stages of osteogenic differentiation induction, which in turn leads to the development of the final stage of osteogenic differentiation, characterized by the formation of calcification. Moreover, the more intensive the initial level of Notch, the stronger and more effective were the processes of osteogenesis.
Conclusion. In this work, we showed that activation of Notch signaling pathway leads to an increase in the osteogenic potential of periodontal PDLSC in a dose-dependent manner and induces in the cells processes associated with the accumu lation of calcifications, the intensity of formation of which directly depends on the “strength” of Notch signal. The results obtained in this work convince us that Notch is able to modulate osteogenic differentiation, affecting its effectiveness, apparently due to the strength of the signal that is transmitted to the cells.
Key words: Notch signaling pathway, osteogenic differentiation, periodontal stem cells.
For citation: Semenova DS, Kostina AS, Mustaeva AM et al. Notch-dependent activation of periodontal cells osteogenic potential. Translyatsionnaya meditsina=Translational Medicine. 2020;7(2): 21–32. (In Russ.) DOI: 10.18705/2311-4495-2020-7-2-21-32.
Список сокращений: СК — стволовые клет ки, CD — кластер дифференцировки (Clusters of Differentiation), GFP — зеленый флуоресцирующий белок (Green Fluorescent Protein), MOI — единицы лентивирусной инфекции, NICD — активированный внутриклеточный домен рецептора Notch1, PDLSC — периодонтальные стволовые клетки (Periodontal Ligament Stem Cells).
Остеогенная дифференцировка является строго регулируемым процессом, осуществляемым специализированными клетками, в том числе остеобластами. Факторы, активирующие широкий спектр генов и клеточных сигнальных путей на ранних стадиях остеогенеза как в норме, так и при патологической кальцификации, остаются предметом активных исследований. Расшифровка ранних механизмов запуска остеогенной дифференцировки важна для потенциальной возможности контролировать данные процессы для индукции остеогенеза, когда необходимо формирование кости, либо же, напротив, для профилактики различных патологических состояний, связанных с эктопической кальцификацией тканей [1].
Стволовые клетки периодонта являются перспективным материалом для применения в стоматологии и челюстно-лицевой хирургии. Эти клетки играют ключевую роль в регенерации периодонтальных тканей: альвеолярной кости, периодонтальных связок и зубного цемента. По своему происхождению эти клетки отличаются от мезенхимных стромальных клеток, они происходят из «нервного гребня», поэтому их часто классифицируют как эктомезенхимные клетки. Эктомезенхимные клетки — это клетки эктодер мального происхождения, приобретшие фенотип мезенхимных стволовых клеток в результате эктомезенхимного перехода в эмбриогенезе. Характерной особенностью стволовых клеток периодонта является их способность дифференцироваться в клетки, синтезирующие зубной цемент, а также в остеобласты. Еще одной чертой стволовых клеток периодонта является их способность к остеогенной дифференцировке вне зависимости от возраста донора. При этом источником для получения таких клеток могут быть молочные зубы во время физиологической смены, удаляемые по ортодон тическим показаниям постоянные зубы (чаще всего третьи моляры), сохранившиеся на них фрагменты тканей периодонта и зубного фолликула, а также фрагменты периодонта, удаляемые во время операций, так называемые «утилизируемые» ткани. Таким образом, все эти особенности делают стволовые клетки периодонта перспективной и уникальной моделью для изучения механизмов остеогенной дифференцировки [2].
Сигнальный путь Notch — эволюционно-консервативный сигнальный путь, который регулирует определение клеточной судьбы, дифференцировку и гомеостаз тканей как в развитии, так и во взрослом организме [3]. Белки Notch представляют собой трансмембранные рецепторы с большим внеклеточным доменом, за которым следует более короткая часть, пронизывающая мембрану, и внутриклеточный домен рецептора (NICD), активирующий транскрипцию. Находясь на поверхности клеточной мембраны, внеклеточный домен рецептора доступен для взаимодействия с лигандами, принадлежащими к Delta (Dll1-4) или Jagged (Jag1 и Jag2) семействам. Эти лиганды экспрессируются на поверхности соседних клеток, и для обеспечения проведения сигнала необходим контакт клетка–клетка. В результате лиганд-рецепторного взаимодействия происходит высвобождение NICD, который перемещается в ядро принимающей сигнал клетки [4–6]. В ядре NICD напрямую связывается с ДНК-связывающим белком CSL (CBF1, Suppressor of Hairless, Lag-1) [7]. Основными транскрипционными мишенями активации Notch считают белки Hes и Hey [8]. Тем не менее спектр прямых мишеней Notch является весьма широким и тканеспецифичным, включая Snail1, p21, c-Myc, EphrinB2 и Nrarp [9–14].
Интерес к роли сигнального пути Notch в про остеогенных событиях в процессе развития и заживления кости вырос за последнее десятилетие. Однако интерпретация данных, полученных на различных экспериментальных моделях, таких как трансгенные мыши и клеточные линии разного происхождения, а также использование различных способов активации Notch, приводит к противоречиям во мнениях относительно того, способствует ли активация Notch остеогенной дифференцировке клеток или же, напротив, при водит к угнетению остеогенеза.
Делеция или мутация одного или нескольких генов сигнального пути Notch приводит к разви тию тяжелых аномалий скелета у людей и в мыши ных моделях [15]. Мутации в генах Jagged-1 (Jag1) или Notch2 вызывают у людей синдром Аладжи ля, аутосомно-доминантное заболевание, характе ризующееся развитием остеопении и повышением риска возникновения переломов. Доминантно-по зитивные активирующие Notch2 мутации вызыва ют синдром Хайду-Чейни, который также имеет измененный фенотип скелета [15]. На клеточных культурах было показано, что активация сигнального пути Notch может как индуцировать [16–19], так и ингибировать [20–22] дифференцировку и минерализацию остеобластов.
В мышиных клетках преостеобластов Notch подавляет созревание остеобластов путем свя зывания NICD или генов-мишеней Notch HES1 и HEY1 с RUNX2 [21, 23, 24]. Недавние работы с использованием клеточных моделей показали, что Notch способствует остеогенной дифференцировке [1, 25–29].
Таким образом, такие противоречивые результаты не дают возможности однозначно ответить на вопрос о роли Notch в остеогенной дифференцировке.
Сигнальный путь Notch характеризуется тканеспецифичностью [30, 31]. Чувствительность к дозе гена была показана для сигнального пути Notch в некоторых экспериментальных системах [312], однако данных в сфере остеогенной дифференцировки немного [1].
Целью данной работы было выяснить, каким образом сигнальный путь Notch влияет на остеогенный потенциал периодонтальных стволовых клеток на раннем этапе индукции дифференцировки — после 48 и 120 часов после запуска остеогенеза. Кроме того, необходимо было определить, существует ли дозозависимость влияния активации Notch на финальную стадию остеогенной дифференцировки, которая характеризуется накоплением кальциевых отложений на модели клеточных линий. Для того чтобы проверить это, мы использовали лентивирусную трансдукцию периодонтальных СК с разным количеством вирусных частиц, несущих последовательность, кодирующую активированный внутриклеточный домен рецептора Notch – NICD. Мы показали, что NICD значительно повышает остеогенный потенциал и минерализацию культур периодонтальных СК дозозависимым образом.
Материалы и методы
Клеточная культура и дифференцировка
Все процедуры, выполненные в исследовании с участием людей, соответствовали этическим стандартам локального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
В качестве основного материала для исследования были использованы стволовые клетки (СК) периодонта человека. Первичные культуры СК от доноров (n = 2) без системных заболеваний и заболеваний периодонта, при отсутствии кариеса выше средней степени, заболеваний пародонта, дентиклей. Средний возраст доноров составлял 15 ± 3,2 года. Для каждого донора было получе но информированное согласие самого донора (при возрасте > 18 лет) или его представителей (для не совершеннолетних пациентов). Клетки выделяли ферментативным методом из фрагментов периодонтальных связок, срезаемых с удаляемых зубов (третьих моляров, показания к удалению — ретенция и/или дистопия).
Среда для культивирования СК периодонта содержала: альфа-МЕМ (Панэко, Россия), 10 % бычьей сыворотки Hyclone (Gibco, США), 1 % пе нициллин/стрептомицин (Invitrogen, США) и 1 % L-глутамин (Invitrogen, США).
Иммунофенотипирование клеток проводили с использованием проточного цитометра Navios (Beckman Coulter) c использованием полупроводниковых диодных лазеров 488 и 638 нм. Использовали следующие панели моноклональных антител (Beckman Coulter) для определения положительных и отрицательных маркеров иммунофенотипа мезен химных стромальных клеток, характерного и для периодонтальных СК: CD44-FITC/CD73-PE/CD9 PC5/CD105-PC7 и CD34-FITC/CD117-PE/CD14-PC5/CD45-PC7. Гейтирование графиков флуоресценции клеточных маркеров проводили по «живым» клет кам (выделены по параметрам прямого и бокового светорассеяния и окрашиванию 7-аминоактиномицином). Границы аутофлуоресценции определяли по неокрашенному контрольному образцу.
Для дифференцировки в остеогенном направлении использовали клетки второго-пятого пассажей, находящиеся в логарифмической фазе роста. За сутки до индукции дифференцировки клетки сеяли на 12 или 24-луночные планшеты в необходимой плотности (70 × 103 клеток/см2), трансдуцировали различным количеством лентивирусных частиц (1, 3, 5, 15 MOI). Для запуска остеогенной дифференцировки клеток использовали следующие факторы: 0,1 мкМ дексаметазона, 50 мкМ аскорбиновой кислоты и 10 мМ β-глицеролфосфа та (Sigma, США). Дифференцировка клеток проходила в течение 18–21 дня. Смену дифференцировочной среды проводили каждые 3 дня.
В качестве контроля в экспериментах использо вали незараженные клетки, в которых была запущена дифференцировка, а также интактные культуры, в которых остеогенная дифференцировка не была индуцирована.
Производство лентивирусных частиц
В основе метода по производству лентивирусных частиц лежит протокол, разработанный в лаборатории Д. Троно и модифицированный в нашей лаборатории [33]. Наработка лентивирусных частиц осуществлялась в клетках линии HEK293-T. Клетки данной линии культивировали в среде DMEM (Gibco, CША) с добавлением 10 % бычьей сыво ротки (Gibco, США), 1 % пенициллин/стрептоми цин (Invitrogen, CША), 1 % L-глутамин (Invitrogen, CША) в инкубаторе с 5 % CO2 при 37 °С.
Первый этап производства лентивирусных частиц заключался в методе с использованием реагента PEI. К 15 мкг векторной плазмиды, содержащей ген интереса — NICD, добавляли 9,73 мкг плазмиды psPAX2 и 5,27 мкг плазмиды pMD2.G, перемешивали и добавляли к 500 мкл DMEM, со держащим 60 мкл PEI. Смесь инкубировали 10–15 минут при комнатной температуре, затем раствор по каплям добавляли к клеткам. Клетки инкубировали в течение 12–17 часов, после чего среду меняли на 7 мл свежей среды. Через сутки проводили концентрирование вирусных частиц путем ультрацентрифугирования, концентрированные таким образом вирусные частицы ресуспендировали в 1 % BSA/PBS и замораживали при −80 °С. Титр вируса определялся по GFP-экспрессирующему вирусу, который производили параллельно с вирусом, несущим ген, кодирующий NICD; эффективность трансдукции СК периодонта вирусом, несущим ген GFP, была 85–90 %.
Окраска дифференцированных в остеогенном направлении СК периодонта
На 18–21 день после запуска остеогенной дифференцировки клетки окрашивали красителем ализариновым красным (Sigma, США), который специфически связывается с отложениями фосфата кальция.
Для окраски клеток удаляли среду и промывали клетки PBS, затем фиксировали клетки холодным раствором 70 % этанола и инкубировали в течение 30–60 минут при комнатной температуре. Затем клетки дважды промывали водой и добавляли краситель, клетки инкубировали с красителем в течение 20 минут. После этого краситель удаляли и лунки промывали несколько раз водой. По результатам окраски проводили качественную и количественную оценку интенсивности прохождения остеогенной дифференцировки периодонтальных СК.
Количественная оценка интенсивности остеогенной дифференцировки СК периодонта
В лунки с окрашенными ализариновым крас ным клетками добавляли раствор 10 % уксусной кислоты, затем инкубировали 10 минут при комнатной температуре. Количественную оценку проводили спектрофотометрически, для этого отбирали 50 мкл экстракта и измеряли поглощение с использованием спектрофотометра (Biorad, США). Необходимая длина волны проходящего пучка света — 420 нм.
ПЦР в реальном времени
РНК из культивируемых клеток выделяли с использованием реагента ExtractRNA (Евро ген, Россия). Тотальная РНК (1 мкг) была об ратно транскрибирована при помощи набора MMLV RT (Евроген, Россия). ПЦР в реальном времени проводили в термоциклере ABI 7500 (Applied Biosystems, США) со следующими тем пературными условиями: 10 минут при 95 °С, 15 секунд при 95 °С и 1 минуту при 60 °С в те чение 40 циклов с охлаждением в конце до 4 °C. Для проведения ПЦР были использованы специ фичные прямые и обратные праймеры для генов интереса (HEY1 F: TGGATCACCTGAAAATGCTG; R: CGAAATCCCAAACTCCGATA. RUNX2: F: GAGTGGACGAGGCAAGAGT; R: GGGTTCCCGAGGTCCATCTA. COL1A1: F: GACCTAAAGGTGCTGCTGGAG; R: CTTGTTCACCTCTCTCGCCA. OGN: F: GGCAATAACACCATTACCTCCC; R: AGGGTGGTACAGCATCAATGT. POSTN: F: CCCAGCAGTTTTGCCCATT; R: TGTGGTGGCTCCCACGAT.). Уровень экспрессии исследуемого гена нормализова ли по уровню экспрессии референсного гена GAPDH (F: AATGAAGGGGTCATTGATGG; R: AAGGTGAAGGTCGGAGTCAA). Данные были проанализированы с помощью программного обеспечения 7500 Software v2.0.6 и были получены значения Ct для каждого гена. Построение кривой плавления было выполнено, чтобы убедиться, что продукт состоял из одного ампликона. Пороговые и базовые значения флуоресценции были установлены в соответствии с инструкциями производителя (SABiosciences, Qiagen, США). Данные были проанализированы с использованием программного обеспечения Qiagen (http://www.sabiosciences. com/pcr/arrayanalysis.php). Изменение уровней экспрессии генов (по сравнению с контрольными образцами) рассчитывали с использованием метода ΔΔCt. Все эксперименты были выполнены в трех независимых биологических повторах.
Информацию, полученная при помощи метода ПЦР в реальном времени, обрабатывали с использованием программ Microsoft Excel и GraphPad Prism. Данные в результатах представлены в виде среднего по всем проведенным экспериментам.
Иммуноблотинг
Для подтверждения присутствия NICD в СК периодонта использовали стандартный метод иммуноблотинга. Сначала клетки культивировали 48 часов, промывали PBS, затем лизировали в 75 мкл лизирующего буфера (50 мМ TrisHCl (pH 8.0), 150 мМ NaCl, 1 % дезоксихолат, 1 % тритон, 0,1 % коктейль ингибиторов протеаз Rouche), ин кубировали 30 минут на льду и осаждали на центрифуге (4 °С, 10 минут, 14000 g). К полученному супернатанту добавляли 25 мкл буфера для внесения (4×SDS буфер) с ß-меркаптоэтанолом (1,7 мкл). Далее пробы кипятили при 95 °С в течение 5 минут и наносили в 10 % полиакриламидный гель. Электрофорез осуществляли в электрофоретической камере (BioRad, США) при режиме: 20 mА — в концентрирующем геле, 40 mА — в разрешающем геле. Затем пробы переносили из геля на нитроцеллюлозную мембрану, в качестве буфера для переноса использовали трис-глициновый буфер с 20 % метанола, при 100 V в течение одного час. Все последующие отмывки проводили в растворе PBS/0.1 % Tween-20. Для блокирования не специфического окрашивания использовали раствор 5 % молоко/PBS/0.1 % Tween-20). Мембрану инкубировали с первичными антителами к белку NICD и B-actin (Santa Cruz, США; 1:200) в течение 16 часов при 4 °С и 1 час при комнатной температуре со вторичными антителами, конъюгированны ми с пероксидазой хрена (BioRad, США; 1:5000). Детекцию осуществляли с помощью системы усиленной хемилюминесценции (Thermo Scientific, США) на приборе ChemiDoc (BioRad, США).
Результаты
По данным иммунофенотипирования, свы ше 95 % клеток экспрессировали поверхностные маркеры CD90+/CD105+/CD73+/CD44+/CD45—/CD14—/CD117—/CD34 (табл. 1). Таким образом, полученная культура клеток обладала иммунофенотипом, сходным с фенотипом мезенхимных стволовых клеток. Небольшой процент CD117+ и CD45+ клеток демонстрировал низкую интенсивность флуоресценции (1–2 относительных единицы флуорес ценции на клетку), поэтому данное окрашивание не может рассматриваться как достоверный результат и может являться артефактом измерения.
Таблица 1. Иммунофенотипирование стволовых клеток периодонта (данные представлены в виде среднего и ошибки среднего по результатам измерений в трех независимо окрашенных пробах)
Поверхностный маркер | Процент позитивных клеток | Интенсивность флюоресценции* |
|---|---|---|
СD90 | 95,6 ± 1,4 | 59,7 ± 6,8 |
CD105 | 99,2 ± 0,9 | 117 ± 2,9 |
CD73 | 99,2 ± 0,5 | 336,0 ± 5,4 |
CD44 | 99,4 ± 0,6 | 76,1 ± 5,4 |
CD45 | 1,8 ± 0,5 | 2,07 ± 0,2 |
CD14 | 1,2 ± 0,7 | 2,99 ± 0,4 |
CD117 | 2,0 ± 1,1 | 1,14 ± 0,8 |
CD34 | 0 | 0 |
Примечание: * — интенсивность флюоресценции представлена в относительных единицах флюоресценции (relative fluorescence units, RFU)
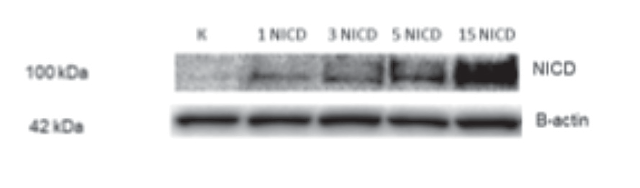
Для анализа влияния сигнального пути Notch на остеогенный потенциал стволовых клеток периодонта мы заразили периодонтальные СК лентивирусными частицами, несущими последовательность, кодирующую активированный внутриклеточный домен рецептора Notch1 — NICD. В первую очередь была проведена оценка, действительно ли происходит синтез белка в ответ на введение NICD в недифференцированные клетки. Для того чтобы доказать, что при увеличении количества вносимого в клетки лентивируса в СК периодонта увеличивается экспрессия, а затем и продукция белка NICD, который в свою очередь влияет на запуск транскрипции гена-мишени Notch — HEY1, мы заразили клетки различными дозами вируса (1, 3, 5, 15 MOI), несущего после довательность, кодирующую NICD. При помощи иммуноблотинга было показано, что при введении экзогенного NICD синтез белка происходил дозо зависимым образом (рис. 1).
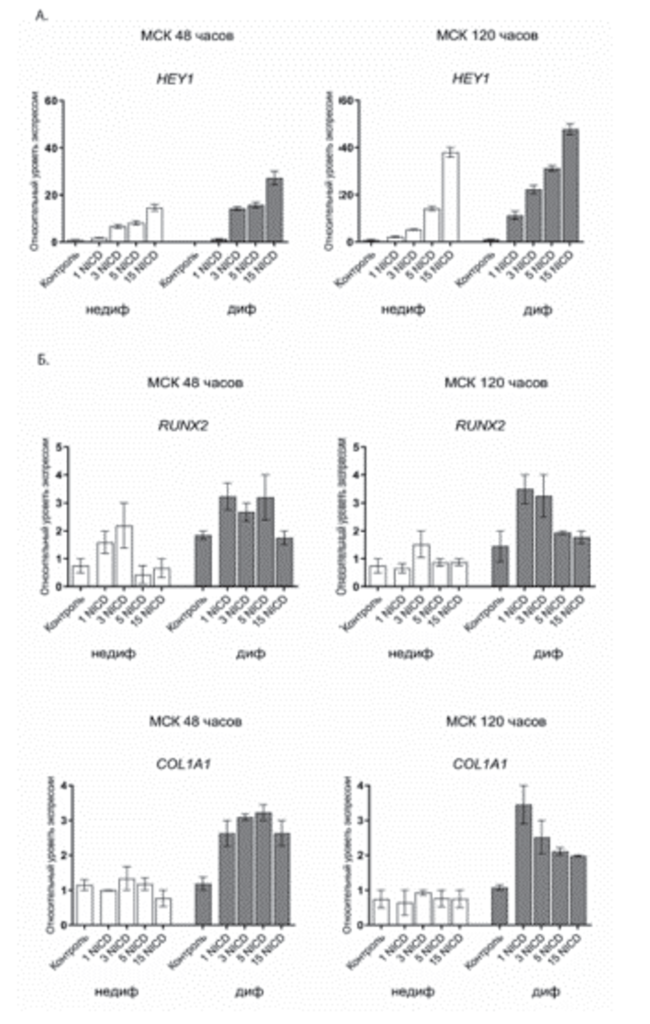
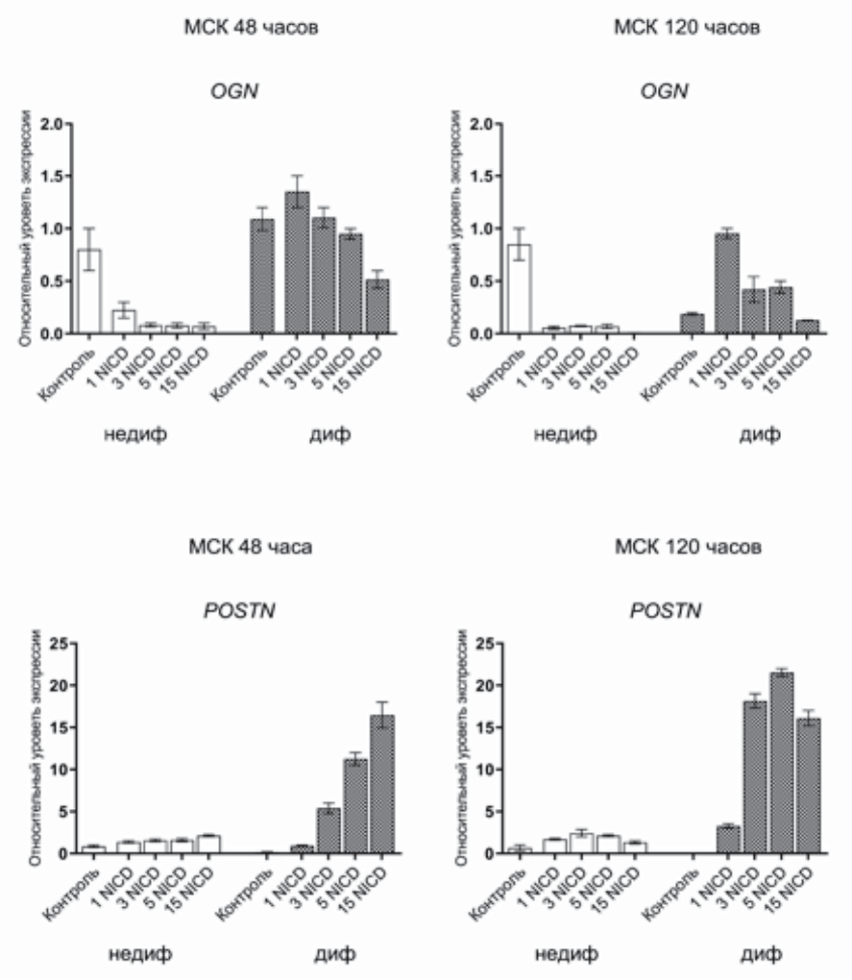
Наша гипотеза, основанная на полученных ранее данных о ключевом влиянии активации Notch на процессы остеогенной дифференцировки в мезенхимных стволовых клетках [1], состояла в том, что различное количество вносимых вирусных частиц приводит к дозозависимому усилению остеогенной дифференцировки СК периодонта. Чтобы проверить так ли это, мы заразили клетки различными дозами вируса (1, 3, 5, 15 MOI), несущего последовательность, кодирующую NICD, после чего проанализировали изменения уровней экспрес сии остеогенных маркеров в клетках, в которых была запущена остеогенная дифференцировка, и контрольных клетках через 48 и 120 часов после начала эксперимента (рис. 2). Было отмечено дозозависимое усиление экспрессии гена-мишени сигнального пути Notch — HEY1 в ответ на внесение в клетки большей концентрации вирусных частиц, кодирующих NICD — 1, 3, 5, 15 MOI (рис. 2А). Очевидно, что экспрессия HEY1 сильнее через 120 часов после индукции остеогенной дифференцировки по сравнению с 48 часами. Кроме того, мы наблюдали, что активация сигнального пути Notch при индукции в клетках остеогенной дифференцировки приводила к усилению уровней экспрессии некоторых остеогенных маркеров — RUNX2, COL1A1, OGN, POSTN (рис. 2Б). Уровни экспрессии остеомаркеров через 120 часов после начала дифференцировки были выше, чем через 48 часов, что соответствовало усилению активности сигнального пути Notch в СК периодонта. Та ким образом, можно говорить о взаимосвязи между уровнем активации сигнального пути Notch и уровнями экспрессии генов-участников ранних этапов остеогенной дифференцировки периодонтальных СК.
На следующем этапе мы проанализировали влияние активации сигнального пути Notch на интенсивность кальцификации клеток in vitro. Мы показали, что внесение в клетки экзогенного NICD при индукции остеогенной дифференцировки приводило к дозозависимому увеличению нако пления отложений фосфатов кальция, детектиру емых специфическим красителем ализариновым красным (рис. 3А). Для количественной оценки интенсивности минерализации культур периодонтальных СК был использован метод экстракции ализаринового красного уксусной кислотой с по следующим спектрофотометрическим измерени ем полученных экстрактов (рис. 3Б). Полученные нами данные свидетельствуют в пользу того, что активация сигнального пути Notch может приводить к усилению экспрессии остеогенных маркеров уже на ранних этапах индукции остеоген ной дифференцировки, таким образом участвуя в формировании кальцификатов. Более того, чем сильнее была активация сигнального пути Notch, в зависимости от увеличения дозы вносимого лентивируса (1, 3, 5, 15 MOI), тем сильнее и эффективнее проходили процессы остеогенной дифференцировки. Это подтверждают повышенные уровни экспрессии остеомаркеров на начальных этапах остеодифференцировки и интенсивные процессы образования отложений кальция на поздних этапах остеодифференцировки.
Обсуждение
Известно, что роль сигнального пути Notch во многом определяется клеточным окружением. Сигнальный путь Notch опосредует широкий спектр молекулярных событий, протекающих на всех эта пах развития организма, таким образом непосред ственно участвуя в поддержании его гомеостаза. Потому неудивительно присутствие в литературе множества противоречивых данных о роли и специфике действия сигнального пути Notch [34, 35]. Одни авторы придерживаются мнения, что сигнальный путь Notch подавляет дифференцировку мезенхимных предшественников в остеобласты и остеокласты, таким образом нарушая согла сованный процесс ремодуляции костной ткани, в ходе которого отмечена активность остеобластов, продуцирующих новый матрикс, и остеокластов, резорбирующих костную ткань [34]. В то же время другие исследователи считают, что результатом активации сигнального пути Notch, напротив, может быть индукция остеогенной дифференциров ки клеток [1, 25]. Имея опыт работы с различными клеточными культурами и зная о том, что активация и характер влияния сигнального пути Notch зависит от окружения и от модельной системы, используемой в работе, мы ставили своей целью рас шифровать механизмы и найти белки, индуцирующие остеогенную дифференцировку в клетках, как при физиологическом образовании кости, так и при патологической кальцификации тканей. На сегодняшний день известно, что механизмы у этих двух процессов сходны и немаловажная роль в них отведена сигнальному пути Notch. Наше исследование,направленное на изучение влияния Notch на процессы остеогенной дифференцировки мезенхимных стволовых клеток, полученных из жировой ткани человека, показало, что данный сигнальный путь вовлечен в молекулярные события, связанные с индуцированием и усилением процессов дифференцировки мезенхимных стволовых клеток [1]. Кроме того, исследования, проводимые на интер стициальных клетках аортального клапана чело века, дали нам возможность говорить о том, что связанные с Notch процессы играют важную роль в механизмах кальцификации аортального клапана [35].
В данной работе мы показали, что активация сигнального пути Notch приводит к повышению остеогенного потенциала СК периодонта дозозависимым образом и индуцирует в клетках процессы, связанные с накоплением кальцификатов, интенсивность образования которых зависит от уровня активации Notch.
Полученные в данной работе результаты подтверждают, что сигнальный путь Notch регулирует остеогенную дифференцировку, влияя на ее эффективность, по-видимому, за счет силы сигнала, который передается клеткам. В используемой экспериментальной системе это было осуществлено при помощи дозирования количества вносимого лентивируса.
Возможность «управлять» остеогенной дифференцировкой является важной, так как, с одной стороны, в целях регенеративной медицины требуется эффективное наращивание костной ткани, в том числе и при помощи остеогенной дифференцировки СК. С другой стороны, нежелательная остеогенная дифференцировка и кальцификация тканей является основой патогенеза многих сердечно-сосудистых заболеваний (склеротические заболева ния сосудов, миокарда, кальцификация аортально го клапана), и возможность предотвращать такую дифференцировку при помощи модуляции клеточных сигналов, в том числе сигнального пути Notch, является актуальной задачей медицины. Учитывая разнонаправленность влияния сигнального пути Notch в разных тканях организма, использование релевантной модельной системы роли сигнального пути Notch определяется поставленной научной задачей. Полученные данные позволяют утверждать, что сигнальный путь Notch участвует в определении соотношения стволовых и дифференцированных клеток в популяции периодонтальных стволовых клеток. Более того, под влиянием остеогенных стимулов сигнальный путь Notch индуцирует и способствует усилению остеогенной дифференцировки СК периодонта.
Конфликт интересов / Conflict of interest
Авторы заявили об отсутствии потенциального конфликта интересов. / The authors declare no conflict of interest.
Благодарности / Acknowledgments
Исследование выполнено при поддержке грантов РФФИ 19-29-04082, 19-315-90051.
Список литературы / References
- Semenova D, Bogdanova M, Kostina A, et al. Dose-dependent mechanism of Notch action in promoting osteogenic differentiation of mesenchymal stem cells. Cell Tissue Res. 2019;379(1):169–179
- Trubiani O, Pizzicannella J, Caputi S, et al. Periodontal Ligament Stem Cells: Current Knowledge and Future Perspectives. Stem Cells Dev. 2019;28(15):995–1003.
- De Strooper B, Annaert W, Cupers P, et al. A presenilin-1-dependent gamma-secretase-like protease mediates release of Notch intracellular domain. 1999;398(6727):518–522.
- Hori K, Sen A, Artavanis-Tsakonas S. Notch signaling at a glance. J Cell Sci. 2013;126(Pt 10):2135–2140.
- Schroeter EH, Kisslinger JA, Kopan R. Notch-1 signalling requires ligand-induced proteolytic release of intracellular domain. 1998; 393(6683):382–386.
- Jarriault S, Brou C, Logeat F, et al. Signalling downstream of activated mammalian Notch. Nature. 1995; 377(6547):355–358.
- Iso T, Kedes L, Hamamori Y. HES and HERP families: Multiple effectors of the notch signaling pathway. J Cell Physiol. 2003; 194(3):237–255.
- Grego-Bessa J, Luna-Zurita L, del Monte G, et al. Notch signaling is essential for ventricular chamber development. Dev Cell. 2007; 12(3):415–429.
- Krebs LT, Deftos ML, Bevan MJ, Gridley T. The Nrarp gene encodes an ankyrin-repeat protein that is transcriptionally regulated by the notch signaling pathway. Dev Biol. 2001;238(1):110–119.
- Rangarajan A, Talora C, Okuyama R, et al. Notch signaling is a direct determinant of keratinocyte growth arrest and entry into differentiation. EMBO J. 2001; 20(13):3427–3436.
- Sahlgren C, Gustafsson M V, Jin S, et al. Notch signaling mediates hypoxia-induced tumor cell migration and invasion. Proc Natl Acad Sci U S A. 2008;105(17):6392– 6397.
- Timmerman LA, Grego-Bessa J, Raya A, et al. Notch promotes epithelial-mesenchymal transition during cardiac development and oncogenic transformation. Genes Dev. 2004; 18(1):99–115.
- Weng AP, Millholland JM, Yashiro-Ohtani Y, et al. c-Myc is an important direct target of Notch1 in T-cell acute lymphoblastic leukemia/lymphoma. Genes Dev. 2006; 20(15):2096–2109.
- Canalis E. Notch in skeletal physiology and disease. Osteoporos Int. 2018;29(12):2611–2621.
- Ugarte F, Ryser M, Thieme , et al. Notch signaling enhances osteogenic differentiation while inhibiting adipogenesis in primary human bone marrow stromal cells. Exp Hematol. 2009; 37(7):867–875.
- Shimizu T, Tanaka T, Iso T, et al. Notch signaling pathway enhances bone morphogenetic protein 2 (BMP2) responsiveness of Msx2 gene to induce osteogenic differentiation and mineralization of vascular smooth muscle cells. J Biol Chem. 2011;286(21):19138–19148.
- Doi H, Iso T, Sato H et al. Jagged1-selective notch signaling induces smooth muscle differentiation via a RBP-Jkappa-dependent pathway. J Biol Chem. 2006; 281(39):28555–28564.
- Tezuka K-I, Yasuda M, Watanabe N, et al. Stimulation of Osteoblastic Cell Differentiation by Notch. J Bone Miner Res. 2002; 17(2):231–239.
- Bai S, Kopan R, Zou W, et al. NOTCH1 regulates osteoclastogenesis directly in osteoclast precursors and indirectly via osteoblast lineage cells. J Biol Chem. 2008; 283(10):6509–6518.
- Hilton MJ, Tu X, Wu X, et al. Notch signaling maintains bone marrow mesenchymal progenitors by suppressing osteoblast differentiation. Nat Med. 2008; 14(3):306–314.
- Shindo K, Kawashima N, Sakamoto K et al. Osteogenic differentiation of the mesenchymal progenitor cells, Kusa is suppressed by Notch signaling. Exp Cell Res. 2003; 290(2):370–380.
- Engin F, Yao Z, Yang T et al. Dimorphic effects of Notch signaling in bone homeostasis. Nat Med. 2008; 14(3):299–305.
- Salie R, Kneissel M, Vukevic M, et al. Ubiquitous overexpression of Hey1 transcription factor leads to osteopenia and chondrocyte hypertrophy in bone. Bone. 2010; 46(3):680–694.
- Liu P, Ping Y, Ma M, et al. Anabolic actions of Notch on mature bone. Proc Natl Acad Sci. 2016;113(15):2152– 2161.
- Cao J, Wei Y, Lian J et al. Notch signaling pathway promotes osteogenic differentiation of mesenchymal stem cells by enhancing BMP9/Smad signaling. Int J Mol Med. 2017; 40(2):378–388.
- Liao J, Wei Q, Zou Y et al. Notch Signaling Augments BMP9-Induced Bone Formation by Promoting the Osteogenesis-Angiogenesis Coupling Process in Mesenchymal Stem Cells (MSCs). Cell Physiol Biochem. 2017; 41(5):1905–1923.
- Liao J, Yu X, Hu X, et al. lncRNA H19 mediates BMP9-induced osteogenic differentiation of mesenchymal stem cells (MSCs) through Notch signaling. Oncotarget. 2017; 8(32):53581–53601.
- Cui J, Zhang W, Huang E, et al. BMP9-induced osteoblastic differentiation requires functional Notch signaling in mesenchymal stem cells. Lab Invest. 2019; 99(1):58–71.
- Andersson ER, Sandberg R, Lendahl U. Notch signaling: simplicity in design, versatility in function. Development. 2011; 138(17):3593–3612.
- Yamamoto S, Schulze KL, Bellen HJ. Introduction to Notch signaling. Methods Mol Biol. 2014; 1187:1–14.
- Guruharsha KG, Kankel MW, Artavanis-Tsakonas
- The Notch signalling system: recent insights into the complexity of a conserved pathway. Nat Rev Genet. 2012; 13(9):654-666.
- Malashicheva A, Kanzler B, Tolkunova E et al. Lentivirus as a tool for lineage-specific gene manipulations. Genesis. 2007; 45(7):456–459.
- Canalis E. Notch signaling in osteoblasts. Sci Signal. 2008;1(17):pe17.
- Regan J, Long F. Notch signaling and bone remodeling. Curr Osteoporos Rep. 2013; 11(2):126–129.
- Kostina A, Shishkova A, Ignatieva E, et al. Different Notch signaling in cells from calcified bicuspid and tricuspid aortic valves. J Mol Cell Cardiol. 2018;114:211–219.
Информация об авторах:
Семенова Дарья Сергеевна, лаборант-исследова тель, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; младший научный сотрудник, ИНЦ РАН;
Костина Александра Станиславовна, младший на учный сотрудник, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; старший научный сотрудник, ИНЦ РАН;
Мустаева Аделия Маратовна, студент, СПбГУ;
Клаузен Полина Евгеньевна, младший научный сотрудник, ИНЦ РАН;
Добрынин Михаил Алексеевич, младший научный сотрудник, ИНЦ РАН;
Боярская Надежда Владимировна, студент, РГПУ им. А. И. Герцена;
Домбровская Юлия Андреевна, к.м.н., ассистент кафедры стоматологи общей практики, ФГБОУ ВО СЗГМУ им. И. И. Мечникова Минздрава России;
Малашичева Анна Борисовна, к.б.н., заведующий НИЛ молекулярной кардиологии Института молекулярной биологии и генетики, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; заведующий НИЛ регенеративной биомедицины, ИНЦ РАН;
Енукашвили Нателла Иосифовна, к.б.н., заведующий НИЛ некодирующей ДНК, ИНЦ РАН; старший научный сотрудник НИЛ клеточных технологий, ФГБОУ ВО СЗГМУ им. И. И. Мечникова Минздрава России.
Author information:
Semenova Daria S., Technician, Almazov National Medical Research Centre; Junior Researcher, Institute of Cytology;
Kostina Aleksandra S., Junior Researcher, Almazov National Medical Research Centre; Senior Researcher, Institute of Cytology;
Mustaeva Adeliia M., Student, Saint Petersburg State University;
Klauzen Polina E., Junior Researcher, Institute of Cytology;
Dobrynin Mikhail A., Junior Researcher, Institute of Cytology;
Boyarskaya Nadezhda V., Student, The Herzen State Pedagogical University;
Dombrovskaya Yulia A., PhD, Department of General Dentistry, North-Western State Medical University named after I. I. Mechnikov;
Malashicheva Anna B., PhD, Head of the Laboratory of Molecular Cardiology, Almazov National Medical Research Centre; Head of the Laboratory of Regenerative Biomedicine, Institute of Cytology;
Enukashvily Natella I., PhD, Head of Laboratory of non-coding DNA, Institute of Cytology; Senior Researcher, Laboratory of Cellular Technologies, North-Western State Medical University named after I. I. Mechnikov.

