Оценка возможности создания фибриновых скаффолдов, заселенных стволовыми клетками пульпы зуба, для замещения костных дефектов челюсти.
https://transmed.almazovcentre.ru/jour/article/view/540/369#
Для цитирования:
Домбровская Ю.А., Енукашвили Н.И., Котова А.В., Билык С.С., Коваленко А.Н., Силин А.В. Оценка возможности создания фибриновых скаффолдов, заселенных стволовыми клетками пульпы зуба, для замещения костных дефектов челюсти. Трансляционная медицина. 2020;7(1):59-69. https://doi.org/10.18705/2311-4495-2020-7-1-59-69
Домбровская Ю.А.1*, Енукашвили Н.И.2,1,**, Котова А.В.2,1, Билык С.С.3, Коваленко А.Н.3, Силин А.В.1
1. Северо-Западный государственный институт им. И.И. Мечникова, Санкт-Петербург, Россия
2. Институт цитологии РАН, Санкт-Петербург, Россия
3. Научно-исследовательский институт травматологии и ортопедии имени Р.Р. Вредена, Санкт-Петербург, Россия
Два первых автора внесли равный вклад в работу.
к.м.н., Домбровская Юлия Андреевна, ассистент кафедры стоматологи общей практики ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России; Yuliya.Dombrovskaya@szgmu.ru
к.б.н., Енукашвили Натэлла Иосифовна, зав. лаб. некодирующей ДНК Института цитологии РАН, старший научный сотрудник НИЛ клеточных технологий СЗГМУ имени И.И Мечникова; n.enukashvily@incras.ru .
Котова Анастасия Викторовна, научный сотрудник НИЛ клеточных технологий СЗГМУ имени И.И Мечникова, старший лаборант-исследователь лаб. некодирующей ДНК Института цитологии РАН; anastkotova@gmail.com
врач-травматолог Билык Станислав Сергеевич, научный сотрудник, Научно-исследовательский институт травматологии и ортопедии имени Р.Р. Вредена, bss0413@gmail.com.
к.м.н. Коваленко Антон Николаевич, старший научный сотрудник Научно-исследовательский институт травматологии и ортопедии имени Р.Р. Вредена; tonnchik@ya.ru.
проф., д.м.н. Силин А.В. заведующий кафедрой стоматологии общей практики ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России. nir@szgmu.ru
Вклад авторов:
- Домбровская Ю.А. — 1) разработка концепции и дизайна исследования; 2) анализ и интерпретация полученных данных; 3) написание рукописи; 4) окончательное утверждение рукописи для публикации; 5) клиническая работа (обследование, анализ компьютерной томографии, постановка диагноза).
- Енукашвили Н.И. 1) разработка концепции и дизайна исследования; 2) анализ и интерпретация полученных данных; 3) написание рукописи; 4) окончательное утверждение рукописи для публикации и др.; 5) работа с клеточными культурами.
- Котова А.В. – экспериментальная работа по изучению свойств фибринового клея, работа с клеточными культурами.
- Билык С.С. визуализация, сегментация и трехмерная реконструкция твердых тканей зубов, костной ткани и границ ее дефектов, 3D-печать.
- Коваленко А.Н. визуализация, сегментация и трехмерная реконструкция костной ткани и границ ее дефектов, 3D-печать.
- Силин А.В. – 1) разработка концепции и дизайна исследования; 2) окончательное утверждение рукописи для публикации.
Fibrin scaffolds containing dental pulp stem cells for the repair of periodontal bone defects.
Dombrovskaya Yu.A.1*, Enukashvily N.I.2,1,**, Kotova A.V.2, 1, Bilyk C.C.3, Kovalenko A.N.3, Silin A.V.1
- North-Western State University named after I.I. Mechnikov, St. Petersburg, Russia
- 2. Institute of Cytology RAS, St. Petersburg, Russia
- 3. Russian Scientific Research Institute of Traumatology and Orthopedics named after R.R. Vreden
* Yuliya.Dombrovskaya@szgmu.ru
Two first authors contributed equally to this work.
Dombrovskaya Yu. A., M.D., PhD., Assistant Prof., Department of General Dentistry North-Western State University named after I.I. Mechnikov, St. Petersburg, Russia; Yuliya.Dombrovskaya@szgmu.ru
Enukashvily N.I., PhD, Head of non-coding DNA Lab, Institute of Cytology RAS, St. Petersburg, Russia. Senior Researcher, Cell Technologies Lab, North-Western State University named after I.I. Mechnikov, St. Petersburg, Russia; n.enukashvily@incras.ru .
Kotova A.V. Researcher, Cell Technologies Lab, North-Western State University named after I.I. Mechnikov; Assistant, Non-coding DNA Lab, Institute of Cytology RAS, St. Petersburg, Russia. anastkotova@gmail.com
Bilyk S.S., M.D., Traumatologist, Researcher, Russian Scientific Research Institute of Traumatology and Orthopedics named after R.R. Vreden, bss0413@gmail.com.
Kovalenko A.N., M.D., PhD. Senior Researcher, Russian Scientific Research Institute of Traumatology and Orthopedics named after R.R. Vreden; tonnchik@ya.ru.
Silin A.V., Prof., Head of General Dentistry Department, North-Western State University named after I.I. Mechnikov, St. Petersburg, Russia nir@szgmu.ru
Authors contribution:
Two first authors contributed equally to this work
Dombrovskaya Yu. A., PhD, conceived and designed the analysis, performed the clinical work (patients examination, diagnostic procedures etc), wrote the paper, analyzed the results of 3D printing, approved the final version of the manuscript
Enukashvily N.I., PhD, conceived and designed the analysis, performed cell culture and scaffold work, wrote the paper, analyzed the results of cell biology experiments, approved the final version of the manuscript
Kotova A.V., cell culture work, experiments with fibrin glue.
Bilyk S.S., M.D., visualization, segmentation and three-dimensional reconstruction of hard tissues of teeth, bone tissue and boundaries of its defects, 3D printing.
Kovalenko A.N., M.D., PhD. visualization, segmentation and three-dimensional reconstruction of hard tissues of teeth, bone tissue and boundaries of its defects, 3D printing.
Silin A.V., Prof., conceived and designed the analysis, approved the final version of the manuscript
Резюме
Актуальность. Подбору трехмерных скаффолдов из биосовместимых материалов в стоматологии уделяется большое внимание. С их помощью можно создать оптимальные условия для дифференцировки клеток, васкуляризации и ремоделировании регенерующей костной ткани.. Тканевая инженерия и 3D-технологии позволяют генерировать трехмерные структурно-функциональные матрицы, которые полностью соответствуют тканям, нуждающимся в реконструкции. Заселение таких скаффолдов клетками, способными к остеогенной дифференцировке, в перспективе может привести к разработке конструкций, позволяющих восстанавливать дефекты костной ткани челюстно-лицевого отдела.
Цель исследования: оценка возможности создания скаффолдов, разработанных на основе 3D-моделирования дефектов костной ткани челюсти и заселенных стволовыми клетками пульпы зуба..
Материалы и методы: Проведен анализ данных компьютерной томографии костной ткани челюстей. Анатомический прототип вестибулярного и небного фрагментов костной ткани с существующими дефектами был создан на основе трехмерной модели с применением 3D-печати. В качестве материала для создания замещающего материала на основе полученных форм использовали фибриновый клей, который получали из концентрата аутологичной плазмы крови с использованием рекомбинатного тромбина неживотного происхождения. Фибриновый клей смешивали с клетками паспортизированной культуры ранних (2-3) пассажей стволовых клеток пульпы зуба.
Результаты: Фибриновый клей приготовленный на основе концентрата аутологичной плазмы (фибриноген 20 г/мл) сохраняет форму в течение 4 дней. На пятый день сжатие сгустка становится хорошо заметным, на 7 день размеры сгустка уменьшаются более, чем на 50%. Пролиферативная активность клеток, при выращивании как внутри скаффолда, так и в 2D условиях на адгезивном культуральном пластике, не различались. Иммунофенотип клеток обеих групп соответствовал иммунофенотипу мезенхимных клеток, что является одним из свойств СКПЗ. Окраска Ализариновым красным клеток как выращиваемых на адгезивном культуральном пластике, так и извлеченных из клея на 10 день после индукции остеогенной дифференцировки не различалась.
Заключение: Показана возможность использования фибринового клея для получения материала c механическими характеристиками, достаточными для получения материала стабильной формы, определяемой 3D матрицей. Доказана способность стволовых клеток пульпы зуба, заключенных в скаффолд на основе фибринового клея сохранять жизнеспособность, иммунофенотип и способность к остеогенной дифференцировке. Таким образом, данная технология в перспективе может быть использована для восстановления костной ткани в стоматологии и челюстно-лицевой хирургии.
Ключевые слова: скаффолд, стволовые клетки пульпы зуба, 3D-печать форм для скаффолдов, костный дефект, фибриновый клей, клеточные технологии в стоматологии
Список сокращений
СКПЗ – стволовые клетки пульпы зуба
Abstract
Background: 3-D scaffolds plays an important role in developing new approaches in modern dentistry. They are used to establish optimal conditions for cell differentiation, vascularization and remodeling of regenerating bone tissue..
Objective: Evaluation of the possibility of creating scaffolds developed on the basis of 3D modeling of periodontal bone defects and containing tooth pulp stem cells.
Materials and Methods: The computer tomography data of the maxillar bone tissue defect were analysed. Anatomical prototype — a mold representing defects of the vestibular and palatal fragments of bone tissue was created by 3D printing. This 3D form was filled with fibrin glue and dental pulp stem cells. The fibrin glue was prepared from autologous blood plasma and mixed with dental pulp stem cells.
Results: Fibrin glue prepared from an autologous plasma concentrate (fibrinogen 20 g / ml) retains its shape for 4 days. On the day 5, the clot retraction became clearly visible and on the day 7, the clot diameter decreased to 57% of the original size. The proliferation rate of cells, grown both inside the scaffold and in 2D conditions, did not differ. The immunophenotype of cells of both groups corresponded to the immunophenotype of mesenchymal stromal cells. The mesenchymal immunophenotype is a feature of dental stem cells. Alizarin red staining of cells both grown on adhesive culture plastic and extracted from glue on day 10 after the induction of osteogenic differentiation did not differ
Conclusion: The fibrin glue is a good material for creation a scaffold with suitable mechanical characteristics. The cells enclosed in the fibrin glue maintain their viability, immunophenotype and osteogenic potential.This technology can be used for bone tissue repair in dentistry and maxillofacial surgery.
Keywords: scaffold, dental pulp stem cells, 3D printed scaffold mold, bone defect, fibrin glue, cell technologies in dentistry.
Введение. Современный мультидисциплинарный подход в решении проблемы создания скаффолд-технологий для регенерации костной ткани актуален и имеет огромный потенциал. Тканевая инженерия и 3D-технологии позволяют генерировать трехмерные структурно-функциональные матрицы — скаффолды, форма которых воспроизводит форму дефекта ткани, нуждающейся в реконструкции [1].
В настоящее время использование трехмерных скаффолдов в различных областях медицины позволяет добиться успешного результата не только за счёт объемного замещения дефекта, но и за счёт стимуляции местных репаративных процессов, способствующих полному восстановлению функции [2].
Подбору трехмерных скаффолдов из биосовместимых материалов в стоматологии уделяется большое внимание. Основное их назначение — создание оптимальных условий для дифференцировки клеток, васкуляризации и ремоделировании регенерирующей костной ткани [3].
Такие скаффолды благодаря точному повторению формы дефекта и биосовместимым материалам (в идеальной ситуации – тканеспецифичным) интегрируются в ткань пациента, являясь источником факторов роста и дополнительной областью клеточной адгезии для прикрепления, пролиферации и функционирования клеток, а внесенные в матрикс стволовые клетки пульпы зуба, будучи мультипотентными и плюрипотентными, способны дифференцироваться в клетки тканей зуба и периодонта [4, 5, 6, 7]. Кроме этого, за счет паракринных механизмов они воздействуют на собственные клетки реципиента, ускоряя процессы регенерации и подавляя воспалительные процессы [4, 8]. Особенностью стволовых клеток пульпы зуба (СКПЗ) и других популяций стволовых клеток ротовой полости является их эктодермальное происхождение при мезодермальном фенотипе[8]. Эти клетки обладают рядом уникальных особенностей, в частности обладают способностью дифференцироваться в одонтобласты, синтезировать межклеточный матрикс дентина и цемента, обеспечивать рост нерва и сосудов пульпы. В связи с этим их рассматривают как перспективный материал для лечения различных заболеваний ротовой полости, а также восстановления ткани пульпы, зубной эмали, периодонта методами регенеративной терапии [4, 8].
Для эффективного функционирования клетки должны быть скомбинированы со скаффолдом, который обеспечит прикрепление, пролиферацию, дифференцировку и миграцию клеток. Скаффолды на основе фибриногена затвердевают за счет расщепления фибриногена аутологичной плазмы крови пациента или донора [9, 10, 11]. Необходимую степень жесткости можно получить, варьируя количество фибриногена и соотношение его с количеством тромбина, а также введением дополнительных компонентов, например, коллагена [ 9, 10, 12]
Целью исследования являлась оценка возможности создания скаффолдов, разработанных на основе 3D-моделирования дефектов костной ткани челюсти и заселенных стволовыми клетками пульпы зуба.
Материалы и методы
Соблюдение этических стандартов
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам локального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики.
Создание 3D модели анатомического прототипа
Проведен анализ данных спиральной компьютерной томографии костной ткани челюстей, выполненных на томографе Toshiba Aquilion Prime, оснащенном алгоритмом подавления металлических артефактов, шаг срезов — 1 мм.
С помощью специализированного программного обеспечения 3D Slicer 4.10.2 на основании срезов компьютерной томографии выполнена визуализация, сегментация и трехмерная реконструкция твердых тканей зубов, костной ткани и границ ее дефектов. Анатомический прототип вестибулярного и небного фрагментов костной ткани с существующими дефектами был создан на основе трехмерной модели с применением 3D-печати на основании технологии послойного сплавления (fused deposition modeling, FDM) филамента из полимолочной кислоты.
Клеточная культура
В работе использована паспортизированная культура ранних (2-3) пассажей стволовых клеток, выделенная из пульпы третьего моляра (№38) мужчины 25 лет. Показаниями к удалению являлись ретенция и дистопия. Паспортизация проводилась на основании внутренних стандартов учреждения (НИЛ клеточных технологий СЗГМУ им. И.И. Мечникова), базирующихся на общей фармакопейной статье МЗ РФ «Требования к клеточным культурам субстратам производства иммунобиологических лекарственных препаратов» [13] и базовым принципам паспортизации клеточных культур для регенеративной терапии [14]. Паспортизация включала в себя: проверку отсутствия инфекций (Mycoplasma genitalium, M. hominis, HIV1,2, Treponema pallidum, HBV, HBC), кариотипирование (46XX, n=25), иммунофенотипирование, оценку жизнеспособности до криоконсервации и после вывода из нее, тест на дифференцировку в трех направлениях (адипо-, остео- и хондрогенном), а также генетическую идентификацию материала. Клетки получали как описано ранее [15]. В дополнение к описанной методике, зуб инкубировали в растворе антибиотика и антимикотика, затем в 70% этаноле (для уничтожения клеток лигаментных связок с целью получения чистой культуры СКПЗ) затем через корневой канал (со стороны верхушки корня, апикальную часть которого удалили для удобства манипуляций) через иглу 31G вводили раствор коллагеназ и инкубировали 1 час при 37С. Диссоциированную ткань пульпы вымывали, промывали изотоничным раствором хлорида натрия и культивировали далее на адгезивном культуральном пластике (TPP, Швейцария) в среде DMEM (1 г/л глюкозы), содержащей 10% ASCM Supplement (HyClone, США), а также антибиотик пенициллин и антимикотик стрептомицин (далее – «стандартные условия»).
Приготовление фибринового клея
Фибриновый клей, содержащий стволовые клетки, получали как описано ранее [10, 11]. В данном исследовании использовали модифицированную методику. Вместо получения фибриногена из криопреципитата, концентрацию фибриногена повышали (до 20 г/л) центрифугируя плазму крови, полученной от того же донора, что и зуб, в концентраторах c диаметром пор 100 кДа (Sartorius, Германия). Концентрацию фибриногена определяли в сторонней организации (Северо-Западный центр доказательной медицины). Для активации образования сгустка добавляли тромбин (200U/мл, Baxter, США) и CaCl2 (2 г/л, Mapichem, Швейцария), в качестве ингибитора фибринолиза использовали ε-аминокапроновую кислоту (2 г/л, Мосфарм, Россия). Концентрация клеток в получаемом геле составляла 1.2 млн/мл. Для оценки ретракции фибринового сгустка клей заливали в лунки 24-луночного планшета, после окончания полимеризации сверху наслаивали физиологический раствор для предотвращения высыхания и измеряли диаметр сгустка через 1, 12, 24, 72, 120 и 168 ч.
Для формирования геля необходимой формы использовали полученный описанным выше способом на основе трехмерной модели анатомический прототип (рис. 1).
Морфофункциональная характеристика СКПЗ
После полимеризации геля, полученный скаффолд, содержащий клетки переносили в культуральную среду и культивировали 7 дней. Для оценки жизнеспособности, иммунофенотипа и остеогенной дифференцировки собирали все клетки – покинувшие гель и оставшиеся в нем. Для извлечения клеток из скаффолда последний вначале измельчали скальпелем на фрагменты примерно 0,5х0,5 см, далее обрабатывали трипсином и инкубировали с плазмой, обедненной по тромбоцитам (platelet poor plasma) 3 ч. при 37℃ как описано Elnager et al., 2014 [16]. Затем образец пипетировали, смешивали с клетками, покинувшими гель и для проточной цитометрии пропускали через фильтровальные сита 70 мкм. Для остеогенной диффренцировки высевали на адгезивный пластик в стандартные условия и далее обрабатывали как описано ниже. Оценивали жизнеспособность (методом проточной цитометрии, окрашивая клетки 7-AAD), пролиферативный потенциал (путем подсчета числа клеток в чашках Петри с нанесенной сеткой для подсчета (Nunc)) и остеогенный потенциал клеток. Для оценки остеогенного потенциала на 8 день культивирования клеток в геле их извлекали из геля, собирали клетки, мигрировавшие из геля и переносили в другую чашку Петри с аналогичной культуральной средой. На следующий день среду заменяли на остеогенную MSCgo™ Rapid Osteogenic Differentiation Medium (Biological Industries, Израиль) и культивировали 10 дней – в данной среде за это время достигается максимальное окрашивание Ализарином, согласно рекомендациям производителя. После этого клетки фиксировали и окрашивали Ализарином [17].
Иммунофенотипирование клеток проводили с использованием проточного цитометра Navios (Beckman Coulter), оборудованного полупроводниковыми диодными лазерами 488 нм и 638 нм и стандартным набором светофильтров от производителя (Синий лазер: 525/40, 575/30, 614/20, 695/30, 755LP; Красный лазер: 660/20, 725/20, 755 LP). Использовали следующие панели моноклональных антител (Beckman Coulter) для определения положительных и отрицательных маркеров иммунофенотипа мезенхимных стромальных клеток, характерного и для СКПЗ: CD44-FITC/CD73-PE/CD90PC5/CD105-PC7 и CD34-FITC/ CD117-PE/ CD14-PC5/ CD45-PC7. Дополнительно использовали третью панель, включающую только антитела к HLA-DR-FITC для определения экспрессии человеческого лейкоцитарного антигена II типа (HLA II класса). Гейтирование графиков флуоресценции клеточных маркеров проводили по «живым» клеткам (выделены по параметрам прямого и бокового светорассеяния и окрашиванию 7-аминоактиномицином). Границы аутофлуоресценции определяли по неокрашенному контрольному образцу. Границы неспецифического связывания антител определяли с помощью изотипических контролей (иммуноглобулины мыши, конъюгированные с FITC, PE, PC5, PC7).
Статистическая обработка данных и критерии статистической значимости.
Все эксперименты выполняли в трех повторностях. Для оценки значимости различий (p <0.05) использовали множественный t-test. Анализ полученных данных и построение графиков проводили в программе GraphPad Prism 7. Данные представлены в виде среднего ± ошибка среднего (M±m).
Результаты
Проведено построение трехмерной модели костей челюсти и зубов на основании сегментирования КТ срезов (рис.1).
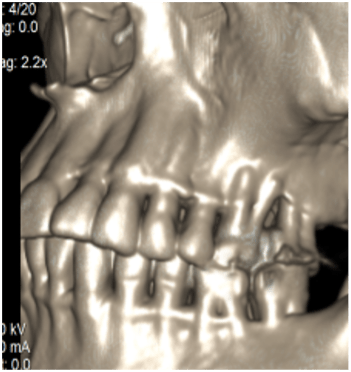
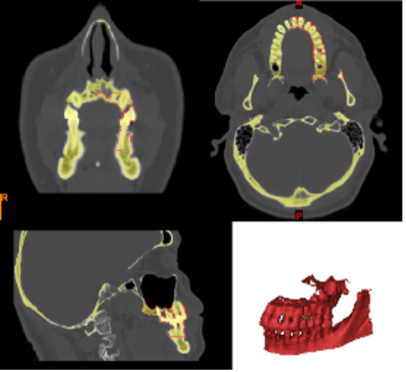
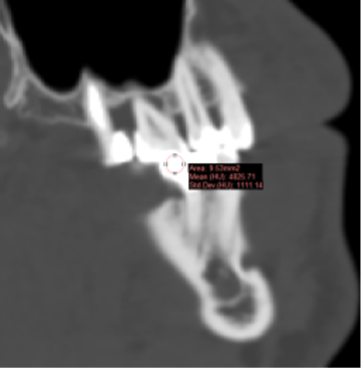
Рис. 1 . Срезы, выполненные при анализе компьютерной томографии. (А) – 3D визуализация твердых тканей верхней и нижней челюстей, (Б) — аксиальная проекция костного дефекта на верхней челюсти слева, (В) – корональная проекция дефектов костной ткани и зубов верхней челюсти.
C помощью полученных 3D-форм с толщиной стенок 1-1,5 мм состоящих из вестибулярной и небной пластин и заполняемых фибриновым клеем и стволовыми клетками пульпы зуба, удалось получить структуры, соответствующие и анатомически полностью восстанавливающие костную ткань (рис. 2). По своей трехмерной структуре синтезированный скаффолд полностью конгруэнтен форме дефекта костной ткани на модели.

Рис. 2. 3D форма для заливки скаффолда, соответствующего имеющемуся дефекту. (А), (Б) –стенки формы, (В) – собранная форма для заливки фибринового клея и клеток.
Пролиферативная активность клеток, как при выращивании внутри скаффолда, так и при стандартных условиях, не различались (рис. 3). Статистически значимых различий в каждой точке между контролем (выращивание в стандартных условиях) и экспериментом (выращивание в фибриновом геле) обнаружено не было.
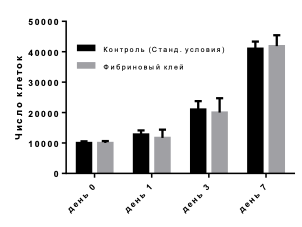
Рис. 3. Пролиферативная активность клеток, выращиваемых в фибриновом клее и в стандартных условиях (контроль). По горизонтали – дни культивирования клеток после пересева. По вертикали – число клеток на лунку. Данные представлены в виде M±m.
Иммунофенотип клеток обеих групп соответствовал иммунофенотипу мезенхимных клеток (табл. 1), что является одним из свойств СКПЗ [4]. Статистически значимых различий зарегистрировано не было. Как и мезенхимные стромальные клетки СКПЗ не презентируют на клеточной поверхности антиген HLA-DR, относящийся к HLA II класса. Мы также не выявили статистически значимых различий в скорости формирования кальцификатов при остеогенной дифференцировке – при использовании выбранной нами среды как время появления первых кальцификатов, так и площадь, ими занимаемая при окончании культивирования в остеогенной среде, статистически значимо не различались (рис.4).
Таблица 1. Иммунофенотип клеток СКПЗ, растущих в стандартных условиях и в фибриновом клее. Данные представлены в виде M±m
Поверхностный маркер | Клетки в фибриновом клее | Клетки в стандартных условиях |
|---|---|---|
СD90 | 99.5±0.82 | 99.4±1.4 |
CD105 | 99.1±1.1 | 99.8±0.85 |
CD44 | 99.7±0.82 | 98.9±1.2 |
CD73 | 98.7±0.91 | 98.8±0.5 |
CD45 | 0.1±0.07 | 0 |
CD34 | 0 | 0 |
CD14 | 0.5±0.12 | 0.4±0.2 |
CD117 | 0.4±0.24 | 0 |
HLA-DR | 0 | 0 |
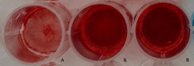
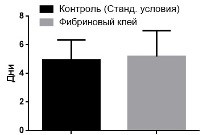
Рис. 4. Остеогенный потенциал СКПЗ, растущих в фибриновом клее. (I) Вид культурального планшета после окрашивания Ализариновым красным кальцификатов клеток, растущих в стандартных условиях (Б) и после культивирования в фибриновом клее (В) на 10 день после добавления остеоиндуктивной среды. Фоновое окрашивание недифференцированных клеток, растущих в стандартных условиях представлено на рис. А. (II) – Диаграмма появления первых кальцификатов после добавления остеоиндуктивной среды. По горизонтали – исследуемые группы, по вертикали – день появления первых кальцификатов. Данные представлены в виде M±m
Для фибриновых клеев характерно быстрое изменение формы за счет сжатия сгустка. Однако, это явление наблюдается при низкой концентрации фибриногена (менее 10 г/л). При использовании нами плазмы, сконцентрированной до концентрации фибриногена 20 г/л, а также ингибитора фибринолиза ε-аминокапроновой кислоты подобное уменьшение не регистрировалось в течение первых 4 дней, через пять дней объем сгустка уменьшался в среднем на 22,0±3,2%, через 7 – на 57,25±4,7% (рис. 5).

Рис. 5. Ретракция сгустка фибринового клея в условиях in vitro под слоем физиологического раствора. (А) Через 1 час после приготовления, (Б) через 5 дней, (В) через 7 дней.
Показано при изучении структуры фибринового клея, что в зависимости от концентрации фибриногена меняются не только реологические, механические параметры сгустка, но и размер пор, образующихся при полимеризации между волокнами фибрина [18]. Наличие пор, размер которых позволяет клеткам мигрировать в/из скаффолда, является желательным параметром при подборе скаффолда. В наших экспериментах при отсутствии изменения формы сгустка в условиях in vitro наблюдалась миграция клеток из фибринового клея (рис. 6), что говорит о том, что поры клея позволяют клеткам мигрировать из клея.
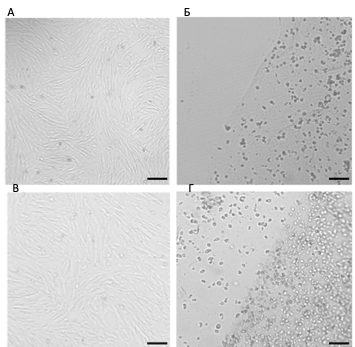
Рис. 6.СКПЗ в фибриновом клее на 2-й (Б) и 4-й день (Г) культивирования. Врезки на (Б) — колонии клеток в геле. Часть клеток покидает фибриновый сгусток. Далее такие клетки распластываются на субстрате и пролиферируют. На 4-сутки культура клеток, покинувших фибриновый клей (В), морфологически неотличима от контрольной (А). Масштабный отрезок – 100 мкм.
Обсуждение
В данной работе мы показали техническую возможность создания заселенного клетками скаффолда, форма которого точно соответствует анатомическому дефекту кости челюсти. Технологии 3D печати постепенно становятся неотъемлемой частью тканевой инженерии по многим причинам, в частности, благодаря тому, что они дают возможность быстрого получения анатомического прототипа, полностью повторяющего форму дефекта или заменяемого фрагмента ткани. То есть дают возможность получения персонализированных конструкций [19]. Подобный подход в настоящее разрабатывается в стоматологии и челюстно-лицевой хирургии [20, 21]. Однако наиболее распространенным подходом, описываемым в данных работах, является печать самого скаффолда, а не формы для него [22]. В этом случае клетки либо накладываются на поверхность скаффолда в виде клеточных слоев либо необходимо существенно сузить набор используемых материалов и техники печати [21]. Использование же форм для заливки дает возможность использовать более широкий набор материалов. Например, фибриновый клей, который для 3D печати непригоден. Также при таком способе создания скаффолда, замещающего дефекты ткани, облегчается введение в него биологически активных веществ и клеток. Сочетание скаффолдов на основе фибринового клея и мезенхимных стромальных клеток (к которым СКПЗ близки по свойствам) позволяет улучшить свойства клеточного материала. Фибриновый клей защищает клетки от оксидативного стресса, позволяет удержать на месте имплантации значительную часть клеток, не меняя их жизнеспособности и не препятствуя секреции паракринных факторов [18, 23].
Мы показали, что свойства данного скаффолда при концентрации фибриногена 20 мг/мл позволяют клетками мигрировать, по крайней мере, из него (рис. 6). Ранее мы показали возможность клеточной миграции из клея при низких концентрациях фибриногена в клее [10]. Позднее Salem et al показали, что способность клеток мигрировать из геля сохраняется при концентрации фибриногена до 20 г/л [18]. При этом, основным фактором, препятствующим миграции является изменение диаметра пор, но не толщины фибриновых волокон [18]. В нашей работе мы использовали фибриновый клей, содержащий ингибитор фибринолиза – ε-аминокапроновую кислоту. Такой фибриновый клей является крупнопористым [24]
Cкаффолд на основе фибринового клея не обладает токсичностью, т.к. изготавливается из компонентов, одобренных для клинического применения (тромбина, аминокапроновой кислоты, хлористого кальция) и аутологичной плазмы пациента. Заключаемые в скаффолд. СКПЗ, как и мезенхимные стромальные клетки не несут на своей поверхности антигенов HLA II класса (табл. 1) и обладают очень низким уровнем экспрессии HLA I класca, вследствие чего обладают очень низким уровнем иммуногенности, не вызывают пролиферации аллореактивных Т-лимфоцитов как до, так и после дифференцировки [25, 26, 27] В связи с этим, мы предполагаем, что разрабатываемый скаффолд, заселенный СКПЗ, биосовместим, что будет проверено в дальнейших исследованиях in vivo.
В наших исследованиях СКПЗ после заключения в гель сохраняли свою жизнеспособность, иммунофенотип и способность к остеогенной дифференцировке. Можно предполагать, что метод 3D–моделирования для создания заливочной формы, в которую заливается исходный материал скаффолда с СКПЗ применим для репаративного остеогенеза и устранения деформаций альвеолярной костной ткани челюстей в методиках направленной тканевой регенерации, исходом которых должен стать восстановленный объем костной ткани, необходимый для успешной остеоинтеграции и полноценного функционирования имплантатов. Стволовые клетки периодонта и СКПЗ обладают способностью восстанавливать периодонт и дефекты кости [28]. Фибриновый клей сам по себе ускоряет восстановление костной ткани, поскольку имитирует образование кровяного сгустка в поврежденном месте, что является естественным стимулятором репаративных процессов в костной ткани [29]. Показано, что использование мезенхимных стромальных клеток в сочетании с фибриновым гелем ускоряет восстановление альвеолярной кости [30].
Сроки биодеградации фибриновых матриксов, по данным литературы, варьируют в зависимости от состава от 3 до 21 дня[24; 31, 32;], что безусловно, требует дополнительного изучения с целью оценки возможностей применения в различных областях стоматологии, т.к. в зависимости от нозологической формы заболевания предъявляются различные требования к срокам биодеградации. В ряде случаев необходимо продление сроков биодеградации скаффолда до 2 месяцев. Для продления сроков дегенерации скаффолда перспективным представляется добавление к фибриновому клею еще одного хорошо исследованного материала для скаффолдов — коллагена [33], добавляемого в различных концентрациях. Длительность биодеградации таких скаффолдов будет проверена нами в дальнейших исследованиях.
В наших исследованиях, СКПЗ в фибриновом клее не утрачивали способности к остеогенной дифференцировке. При развитии костных дефектов челюсти происходит резорбция костной ткани., что связано с активацией остеокластов и изменением активности остеобластов вследствие повышенной выработки тканями пародонта провоспалительных цитокинов и медиаторов — интерлейкина-1, фактора некроза опухоли α, интерферон γ, костные морфогенетические белки, простогландина –Е2, матричной металлопротеазы и др [34]. Различными исследователями доказано, что стволовые клетки ротовой полости, в том числе, находящиеся в строме пульпы зуба, участвуют в процессах восстановления поврежденной костной ткани. СКПЗ обладают высоким остеогенным потенциалом [4, 5], поэтому их использование для восстановления костной ткани является перспективным методом трансляционной медицины.
Иммуногенные свойства скаффолдов напрямую зависят от материала, входящих в их состав, в данном скаффолде предполагается использовать в качестве источника фибриногена кровь пациента. Использование аутологичных материалов снижает риск иммунизации пациента.
Выводы.
3D-моделирование и печать позволяют создать точную трехмерную копию дефекта костной ткани из биоинертных материалов, с полностью конгруэнтными поверхностями, что в дальнейшем дает возможность заполнения скаффолдами и стволовыми клетками пульпы зуба. Нами предполагается, что данная методика может быть использована в различных методиках для восстановления челюстно-лицевой области.
Использованный нами скаффолд на основе фибринового клея не влияет на ключевые свойства стволовых клеток пульпы зуба – жизнеспособность, пролиферационную активность, иммунофенотип, способность к остеогенной дифференцировке. Таким образом, он является перспективным материалом для создания заселенных клетками имплантов, предназначенных для восстановления костных дефектов челюсти.
Благодарности: Работа выполнена в рамках НИР (№АААА-А18-118052990081-0) Государственного Задания Министерства Здравоохранения Российской Федерации №056-00056-19-00. Авторы благодарят Покровский Банк стволовых клеток за помощь в освоении методики культивирования стволовых клеток пульпы зуба.
Конфликт интересов / Conflict of interest
Авторы заявили об отсутствии потенциального конфликта интересов. / The authors declare no conflict of interest.
Литература:
- Nyberg EL, Farris AL, Hung BP, Dias M, Garcia JR, Dorafshar AH, Grayson WL. 3D-Printing Technologies for Craniofacial Rehabilitation, Reconstruction, and Regeneration. Ann Biomed Eng. 2017;45(1):45-57.
- Ivanov AN, Norkin IA, Puchin’ian DM. The possibilities and perspectives of using scaffold technology for bone regeneration. Tsitologiia. 2014;56(8):543-8. In Russian [Иванов А.Н., А.Н., Норкин И.А., Пучиньян Д.М. Возможности и перспективы использования скаффолд-технологий для регенерации костной ткани. Цитология. 2014. 56(8): 543-548.]
- Яременко А.И., Галецкий Д.В., Королов В.О. Современные остеопластические и остеоиндуктивные материалы. Состояние проблемы. Перспективы применения в стоматологии и челюстно-лицевой хирургии. Институт стоматологии. 2011. 2(51):70-71.
- Sharpe PT. Dental mesenchymal stem cells. Development. 2016 Jul 1;143(13):2273-80.
- Liu L, Wei X, Ling J, Wu L, Xiao L. Expression pattern of Oct-4, Sox2, and c-Myc in the primary culture of human dental pulp derived cells. J Endod. 2011;37(4):466-72.
- Atari M, Gil-Recio C, Garcia-Fernandes D. et al. Dental pulp of the third molar: a new source of pluripotent-like stem cells. J Cell Sci. 2012;125:3343-3356.
- Martínez-Sarrà E, Montori S, Gil-Recio C. et al. Human dental pulp pluripotent-like stem cells promote wound healing and muscle regeneration. Stem Cell Res Ther. 2017; 8:175-195.
- Grimm WD, Dannan A, Giesenhagen B, Schau I, Varga G, Vukovic MA, Sirak SV. Translational Research: Palatal-derived Ecto-mesenchymal Stem Cells from Human Palate: A New Hope for Alveolar Bone and Cranio-Facial Bone Reconstruction. Int J Stem Cells. 2014;7(1):23-9.
- Uehara K, Zhao C, Gingery A, Thoreson AR, An KN, Amadio PC. Effect of Fibrin Formulation on Initial Strength of Tendon Repair and Migration of Bone Marrow Stromal Cells in Vitro. J Bone Joint Surg Am. 2015; 97(21):1792-8.
- Enukashvily NI, Aizenshtadt AA, Bagaeva VV et al. Assessing the possibility to apply the fibrin glue made of cord blood plasma as a scaffold for mesenchymal stem cells transplantation. HERALD of North-Western State Medical University named after II Mechnikov. 2017. 9(2), 35-44. In Russian [Енукашвили Н.И., Айзенштадт А.А., Багаева В.В., Супильникова О.В., Иволгин Д.А., Масленникова И.И., Новикова С.В., Адылов Ш.Ф. Оценка возможности применения фибринового клея на основе пуповинной крови в качестве скаффолда для мезенхимальных стволовых клеток. Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. 2017. 9(2), 35-44.]
- Bagaeva VV, Ajzenshtadt AA, Savintsev AM et al. Method for obtaining of two-component preparation for treatment of joints damage by low-invasive introduction into joint bag and preparation obtained by this method. Patent of Russian Federation RU 2 638 796 C1. Bulletin FIPS=FIPS Bulletin. 2017. Issue35. In Russian [Багаева ВВ, Айзенштадт АА, Савинцев АМ. и др. Способ получения двухкомпонентного препарата для лечения повреждения суставов путем малоинвазивного введения в суставную сумку и препарат, полученный этим способом Патент РФ. RU 2 638 796 C1. Бюлл ФИПС. 2017; Вып.35.]
- Egorikhina MN, Aleynik DY, Rubtsova YP, Levin GY, Charykova IN, Semenycheva LL, Bugrova ML, Zakharychev EA. Hydrogel scaffolds based on blood plasma cryoprecipitate and collagen derived from various sources: Structural, mechanical and biological characteristics. Bioact Mater. 2019 Oct 31;4:334-345.
- General pharmacopeia article «Requirements for cell cultures — substrates for the production of immunobiological drugs. OFS.1.7.2.0011.15» («State Pharmacopoeia of the Russian Federation. XIII edition. Volume II»)». In Russian. [Общая фармакопейная статья «Требования к клеточным культурам — субстратам производства иммунобиологических лекарственных препаратов. ОФС.1.7.2.0011.15» («Государственная фармакопея Российской Федерации. XIII издание. Том II»)]
- Supotnitskiy MV, Elapov AA, Merkulov VA, et al. Common technological processes used in manufacture of biomedical cell culture products. Biopreparaty= Biopharmaceuticals. 2015;(2):36–45. In Russian [Супотницкий МВ, Елапов АА, Меркулов ВА, Борисевич ИВ, Климов ВИ, Миронов АН. Основные технологические процессы, используемые при производстве биомедицинских клеточных продуктов. Биопрепараты. 2015; (2): 36–45.]
- Bagaeva VV, Enukashvili NI, Elsukova LV et al. Method for extracting a tooth pulp for receiving a culture of stem cells. Patent of Russian Federation 2017 143 739. Oficialny Bulletin FIPS=Official FIPS Bulletin. 2019. №4. In Russian [Багаева ВВ, Енукашвили НИ, Елсукова ЛВ. Способ извлечения пульпы зуба для получения культуры стволовых клеток. Патент РФ № 2679082. Официальный бюллетень ФИПС. 2019. №4.]
- Elnager A, Abdullah WZ, Hassan R et al. In vitro whole blood clot lysis for fibrinolytic activity study using d-dimer and confocal microscopy. Adv Hematol. 2014;2014:814684.
- Inflammation and Mechanical Stress Stimulate Osteogenic Differentiation of Human Aortic Valve Interstitial Cells. Bogdanova M, Kostina A, Zihlavnikova Enayati K, Zabirnyk A, Malashicheva A, Stensløkken KO, Sullivan GJ, Kaljusto ML, Kvitting JP, Kostareva A, Vaage J, Rutkovskiy A. Front Physiol. 2018 Nov 20;9:1635.
- Salam N, Toumpaniari S, Gentile P. Assessment of Migration of Human MSCs through Fibrin Hydrogels as a Tool for Formulation Optimisation. Materials (Basel). 2018; 11(9):e1781-1795.
- Khang G. Handbook of Intelligent Scaffolds for Tissue Engineering and Regenerative Medicine. Jenny Stanford Publishing. 2017. 1440 p.
- Park SA, Lee HJ, Kim KS et al. In Vivo Evaluation of 3D-Printed Polycaprolactone Scaffold Implantation Combined with β-TCP Powder for Alveolar Bone Augmentation in a Beagle Defect Model. Materials. 2018; 11:238-249.
- Tao O, Kort-Mascort J, Lin Y. et al. The Applications of 3D Printing for Craniofacial Tissue Engineering. Micromachines. 2019; 10(7):480-498.
- Maroulakos M, Kamperos G, Tayebi L. et al. Applications of 3D printing on craniofacial bone repair: A systematic review. J Dent. 2019;80:1-14.
- Kim I1, Lee SK, Yoon JI. Fibrin glue improves the therapeutic effect of MSCs by sustaining survival and paracrine function. Tissue Eng Part A. 2013; 19(21-22):2373-81.
- Hedrich HC, Simunek M, Reisinger S. et al. Fibrin chain cross-linking, fibrinolysis, and in vivo sealing efficacy of differently structured fibrin sealants. J Biomed Mater Res B Appl Biomater. 2012; 100(6):1507-12.
- Le Blanc K, Tammik C, Rosendahl K. et al. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp. Hematol. 2003;31:890-896.
- Wang Y, Huang J, Gong L. et al. The Plasticity of Mesenchymal Stem Cells in Regulating Surface HLA-I. iScience. 2019; 15:66-78.
- Iohara K, Utsunomiya S, Iohara S. et al. Allogeneic transplantation of mobilized dental pulp stem cells with the mismatched dog leukocyte antigen type is safe and efficacious for total pulp regeneration. Stem Cell Research & Therapy. 2018; 9:116-132.
- Amghar-Maach S, Gay-Escoda C, Sánchez-Garcés M. et al. Regeneration of periodontal bone defects with dental pulp stem cells grafting: Systematic Review. J Clin Exp Dent. 2019;11(5):e373-81.
- Bujoli B, Scimeca JC, Verron E. Fibrin as a Multipurpose Physiological Platform for Bone Tissue Engineering and Targeted Delivery of Bioactive Compounds. Pharmaceutics. 2019;11(11). E556-571.
- Zhang L, Wang P, Mei S et al. In vivo alveolar bone regeneration by bone marrow stem cells/fibrin glue composition. Arch Oral Biol. 2012; 57(3):238-44.
- Buchta C, Hedrich HC, Macher M. et al. Biochemical characterization of autologous fibrin sealants produced by CryoSeal and Vivostat in comparison to the homologous fibrin sealant product Tissucol/Tisseel. Biomaterials. 2005; 26(31):6233-41.
- Harris DM, Siedentop KH, Ham KR, Sanchez B. Autologous fibrin tissue adhesive biodegration and systemic effects. Laryngoscope. 1987 Oct;97(10):1141-4.
- Shekhter AB, Guller AE, Istranov LP, Istranova EV, Butnaru DV, Vinarov AZ, Zakharkina OL, Kurkov AV, Kantimerov DF, Antonov EN, Marisov LV, Glybochko PV. Morphology of collagen matrices for tissue engineering (biocompatibility, biodegradation, tissue response). Arkh Patol. 2015 Nov-Dec;77(6):29-38. In Russian [Шехтер А.Б., Гуллер А.Е., Истранов Л.П., Истранова Е.В., Бутнару Д.В., Винаров А.З., Захаркина О.Л., Курков А.В., Кантимеров Д.Ф., Антонов Е.Н., Марисов Л.В., Глыбочко П.В. Морфология коллагеновых матриксов для тканевой инженерии (биосовместимость, биодеградация, тканевая реакция). Архив патологии. 2015;77(6):29-38.]
- Вольф, Герберт Ф. Пародонтология : цветной атлас : пособие : руководство; пер. с нем.: [О. Н. Лукинская] ; под ред. Г. М. Барера. — 2-е изд. — Москва: МЕДпресс-информ, 2014. — 548 с. : ил., портр., цв. ил., табл.;

