Клеточные технологии в гепатологии
ВАЖНО! Данная информация предназначена для специалистов в области здравоохранения
Биотехнологический центр
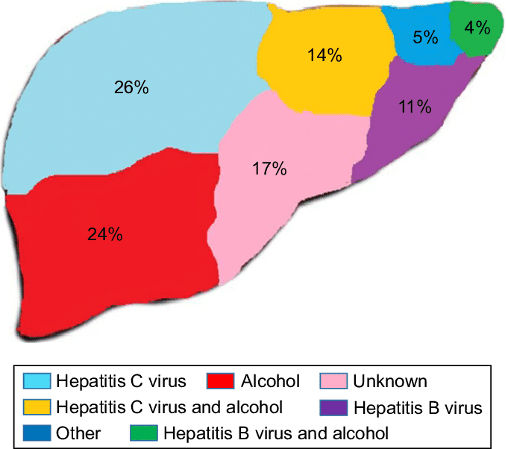
В настоящее время по данным ВОЗ , ежегодно от цирроза печени умирает около 2 миллионов человек. На долю гепатита, рака и цирроза печени приходится около 5% всех случаев смерти в мире и ожидается, что в последующие два десятилетия их число будет возрастать. Течение ХГ характеризуется воспалительно-дистрофическим поражением ткани печени, а также развитием фиброза и цирроза. Подобные изменения приводят к деградации митохондрий и лизосом гепатоцитов.
Применение современных методов лечения не позволяет получать желаемую эффективность проводимой терапии. При хронических заболеваниях печени (циррозах) в конечной стадии заболевания единственно возможным методом лечения является трансплантация, которая не всегда возможна ввиду отсутствия донора. В связи с этим ведется поиск возможных путей терапевтического лечения заболеваний печени. Одним из новых подходов является использование методов регенеративной, в частности, клеточной терапии. Разработка новых технологий ведется в двух направлениях:
1) сдерживание развития заболевания путем стимулирования эндогенной регенерации и ингибирования фиброза
2) при невозможности избежать трансплантации клеточная терапия используется для поддержания функций печени и, в идеале увеличения выживаемости в листе ожидания [1,2].
В настоящий момент рассматриваются различные технологии клеточной терапии: с применением аллогенных (донорских) или ксеногенных (межвидовое донорство) гепатоцитов, а также с применением различных по происхождению и потентности стволовых клеток (СК). Последние могут использоваться для снижения скорости фибротических изменений при циррозах, повреждений печени за счет аутоиммунных процессов, а также как материал для получения гепатоцитов для трансплантации или заселения экстракорпоральных искусственных биоаналогов печени. Для таких целей могут быть использованы клетки-предшественники гепатоцитов – гепатобласты из фетальной печени, индуцированные плюрипотентные клетки и т.д. Однако использование этих источникам по различным причинам затруднено. Так, получение фетальных гепатобластов приводит к возникновению биоэтических проблем. При использовании индуцированных плюрипотентных клеток пока не удается решить вопросы биобезопасности клеточных продуктов. Поэтому наиболее перспективными считаются мезенхимные стромальные (стволовые) клетки, обладающие помимо способности к дифференцировке в гепатоцитарном направлении способны поддерживать функции печени за счет секреции антиапоптотических, противовоспалительных, иммуномодулирующих, пролиферативных факторов.
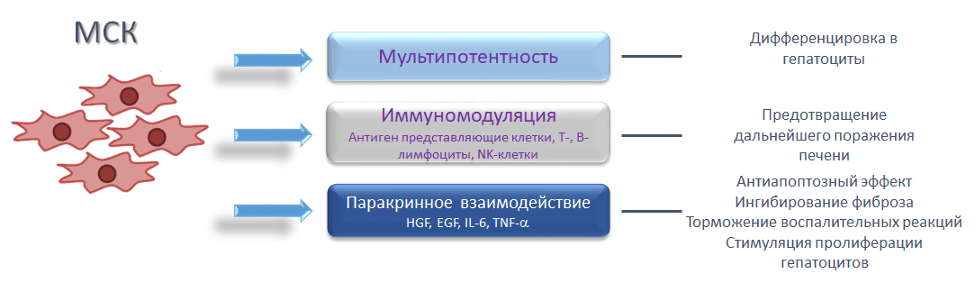
В результате такого паракринного воздействия на окружающие клетки, мезенхимные стромальные клетки способны подавлять активность лимфоцитов и тормозить аутоиммунное разрушение тканей печени, а также стимулировать эндогенную регенерацию [1].
Для проведении лечения с использованием методов клеточной терапии рассматривается два возможных препарата – мононуклеарная фракция костного мозга и культивированные стволовые (мезенхимные или гемопоэтические) клетки. Мононуклеарная фракция костного мозга — это клетки, выделенные из костного мозга посредством отделения от эритроцитов, тромбоцитов и гранулоцитов на градиенте плотности или методом двойного центрифугирования. В ее составе присутствуют лимфоциты, гемопоэтические и мезенхимные стромальные клетки. Мононуклеарная фракция костного мозга может быть получена «у постели больного» и относится к минимально манипулированным продуктам. Отсутствие этапа культивирования клеток повышает биологическую безопасность такого препарата. Однако, процент стволовых клеток в таких препаратах невысок – от 0,5 до 10% в зависимости от способа получения. Поэтому в забираемом при пункции костном мозге общее количество стволовых клеток может быть небольшим. Большое количество разнообразных клеточных популяций затрудняет прогнозирование действия препарата. Альтернативным вариантом является использование культивированных мезенхимных стромальных или гемопоэтических клеток. В этом случае, решается проблема количества клеток и повышается однородность препарата. Однако, этап культивирования клеток предъявляет повышенные требования к контролю качества таких препаратов.
Покровский Центр клеточных технологий совместно с НИЛ клеточных технологий СЗГМУ им. И.И. Мечникова в рамках Государственных заданий принимает участие в проведении трех исследований направленных на развитие методов регенеративной терапии для гепатологии.
Первые два исследования направлены на разработку методов, сдерживающих развитие фиброзов и стимулирующих эндогенную регенерацию. Сотрудниками Центра показана возможность применения как мононуклеарной фракции крови [2,3], так и мезенхимных стромальных клеток печени и жировой ткани [4–6] для улучшения функций печени и качества жизни у пациентов с хроническими заболеваниями печени различной этиологии.
Совместно с СЗГМУ им. И.И. Мечникова нами было проведено лечение 30 пациентов с хроническими заболеваниями печени, которое помимо стандартной терапии было дополнено введением мононуклеарной фракции. Всем пациентам была проведена биопсия печени с иммуногистохимическим исследованием до начала регенеративной терапии и через 6 месяцев после нее. Результаты показали выраженное снижение долькового и портального воспаления, а также уменьшение лимфоцитарной инфильтрации ткани печени. В 90% случаев отмечался регресс фиброза на 1–2 степени. Также отмечалась нормализация показателей цитолиза и холестаза. На фоне проведенного исследования можно заключить, что мононуклеарная фракция оказывает выраженное противовоспалительное действие, снижая хемотаксис лимфоцитов в ткани печени за счет выделения противовоспалительных цитокинов, а также меняет компартмент образования
соединительной ткани в печени, что способствует регрессии выраженности фиброза вплоть до полного восстановления структуры ткани печени [2,3].
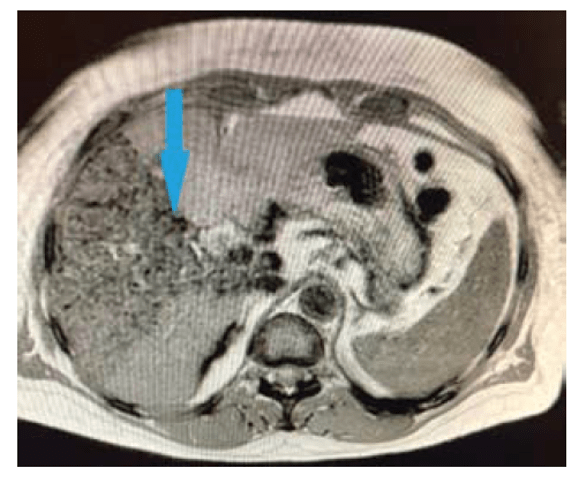
Для использовании культивированных мезенхимных стромальных клеток, выделенных из печени или жировой нами был разработан метод введения клеточного материала в артериальное русло печени, обеспечивающий таргетную доставку клеток к поврежденному участку печени [5]. Для удобства визуализации клеток в организме и подтверждения их доставки к тканям печени мы разработали метод мечения клеток непокрытыми наночастицами оксида железа [5,7]. Такой метод позволяет визуализировать вводимый материал с помощью магнитно-резонансной томографии.
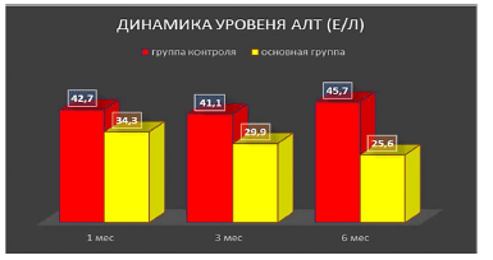
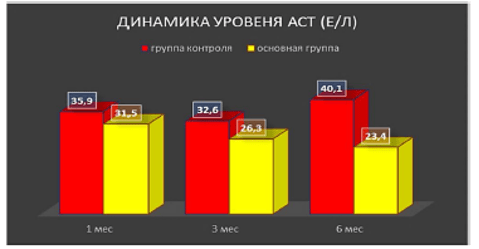
Динамика уровня средних значений печеночных ферментов через 1, 3 и 6 мес после введения аутологичных мезенхимальных стволовых клеток в артериальное русло печени пациентам с диффузными заболеваниями печени (из Коткас и др., 2020а)
Согласно нашим данным, культивированные мезенхимные стромальные клетки, вводимые в артериальное русло печени также улучшают показатели состояния функций печени [4–6]. Данные гистологического анализа биоптатов показывают наличие клеток, содержащих наночастицы, через 6 и 12 мес. после введения в организм.
Таким образом, по нашим данным, и мононуклеарная фракция костного мозга, и культивируемые аутологичные мезенхимальные стволовые клетки способны улучшать состояние печени. Разработанные нами методы позволяют вводить клеточносодержащие препараты как через системный кровоток, так и локально, непосредственно в поврежденные участки печени. При этом возможен контроль за распределением клеточного материала с помощью магнитно-резонансной хроматографии.
Третье направление исследований направлено на разработку способов снижения смертности пациентов в листе ожидания на трансплантацию. Совместно со специалистами Российского научного центра радиологии и хирургических технологий был разработан способ доставки препаратов мононуклеарной фракции пуповинной крови в печень для поддержания функциональной стабильности печени при циррозе у пациентов из листа ожидания [8]. Введение клеток проводилось внутрипортально с предварительным выполнением прямой портографии и портофлоуметрии для определения скорости инфузии мононуклеарной фракции только после определения оптимальной скорости перфузии сегментарных ветвей портальной вены. В отдаленном периоде наблюдения (5–12 мес.) прогрессирования болезни не произошло, значимо улучшилось качество жизни (опросник SF-36). При морфологическом и ИГХ-исследовании биоптатов печени отмечено увеличение количества двуядерных клеток, Ki67, АФП, уменьшение степени стеатоза печени. При оценке показателя МЕLD отмечено снижение на 2 балла. В 2 случаях уменьшилась тяжесть заболевания по CTP с класса B до А. Разработанный способ доставки МНК в печень через портальную вену позволяет минимизировать потерю клеток по ее коллатералям во время введения и позволяет максимально концентрировать их в печени, что делает лечение персонализированным, обеспечивая индивидуальный
подход к больному. Данная методика является относительно безопасной и перспективной для дальнейших исследований.
Список литературы
- Nicolas C. et al. Cell Therapy in Chronic Liver Disease HHS Public Access // Curr Opin Gastroenterol. 2016. Vol. 32(3), № 3. P. 189–194.
- Приходько Е.М. и др.. Регенеративная терапия мононуклеарной фракцией крови нарушений липидного обмена при хронических гепатитах // Экспериментальная и клиническая гастроэнтерология. 2017. Vol. 138, № 2. P. 56–61.
- Приходько Е.М., Селиверстов П.В., Радченко В.Г. Возможности регенеративной терапии у пациентов с хроническим гепатитом // Гастроэнтерология Санкт-Петербург. 2016. Vol. 3–4. P. M20.
- Kotkas I.E. et al. Visualisation of the distribution of autologous mesenchymal cells introduced into a body of a patient suffering from cirrhosis of the liver nutritional etiology // Her. North-Western State Med. Univ. named after I.I. Mechnikov. 2017. Vol. 9, № 4. P. 76–78.
- Kotkas I.E. et al. Autologous mesenchymal stem cells in treatment of liver cirrhosis: evaluation of effectiveness and visualization method // Sci. Innov. Med. 2020. Vol. 5, № 3. P. 197–203.
- Kotkas I.E., Enukashvily N.I., Asadulaev S.M. Efficiency of Using Cellular Technologies in the Treatment of Patients With Diffuse Liver Diseases // J. Volgogr. State Med. Univ. 2020. Vol. 73, № 1. P. 88–92.
- Enukashvily N.I. et al. Detection of Cells Containing Internalized Multidomain Magnetic Iron (II, III) Oxide Nanoparticles Using the Magnetic Resonance Imaging Method // Tech. Phys. 2020. Vol. 65, № 9. P. 1360–1369.
- Шералиев А.Р. и др. Первый опыт внутрипортального введения мононуклеарных клеток аутологичного костного мозга у пациентов в листе ожидания трансплантации печени // Вестник трансплантологии и искусственных органов. 2017. Vol. 19S. P. 118.

