Фибробласты в клеточных технологиях
ВАЖНО! Данная информация предназначена для специалистов в области здравоохранения
Биотехнологический центр
Фибробласты кожи в регенеративной терапии
Фибробласты кожи — это основные клетки дермы, соединительнотканного слоя кожи. Они синтезируют так называемые факторы роста, цитокины, стимулирующие рост коллагеновых, эластических, ретикулярных волокон в коже. Основы современных представлений о фибробластическом диффероне были заложены А.А. Максимовым, А.А. Заварзиным, Н.Г. Хлопиным. В настоящее время эти представления были существенно дополнены на основании современных данных [1]. В настоящее время считается, что фибробласты – это совокупность различных по происхождению, по степени дифференцированности и морфофункциональным признаком группа клеток, которые принято объединять термином фибробластический дифферон.
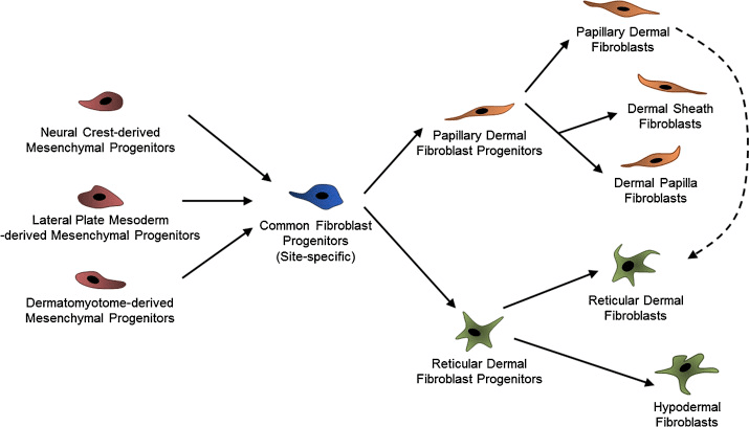
В отечественной литературе используется следующая классификация, основанная на классических представлениях и современных данных о совокупности морфофункциональных характеристик и пролиферативном потенциале фибробластов [1, 2]:
• полипотентные клетки-предшественницы;
• префибробласты – коммитированные клетки предшественницы;
• юные фибробласты;
• дифференцированные фибробласты – центральное звено фибробластического дифферона.
• конечный тип клеток фибробластического дифферона:
– фиброциты;
– миофибробласты;
– фиброкласты.
Из различных участков кожи, преимущественно из неонатальной ткани крайней плоти человека было выделено несколько популяций фибробластов, обладающих мультипотентными или прогениторными свойствами: SKP (skin-derived progenitors, эмбриональные эндогенные клетки-предшественницы, мигрирующие в ткани организма во время развития, и сохраняющие свою мультипотентность во взрослом организме), дермальные мультипотентные мезенхимные стволовые клетки, мультипотентные дермальные фибробласты (MDFs). Все эти клетки являются активно пролиферирующими, но различаются по своей способности к дифференцировке. Наиболее пластичными являются MDF, способные к дифференцировке не только в мезенхимные, но и в эндодермальные клетки.. Еще одной особенностью дифференцированных фибробластов является их способность секретировать компоненты внеклеточного матрикса соединительных тканей и таким образом поддерживать их структуральную целостность [3].
Данные свойства фибробластов обусловили интерес к этим клеткам с точки зрения их возможного применения в регенеративной терапии. В настоящее время на рынке США представлено несколько клеточносодержащих препаратов, одобренных FDA. Из них два изготавливаются на основе фибробластов: дермальных (LaViV, для применения в косметологии) и гингивиальных (Gintuit, для заживления ран при мукогингивальных операциях).

Основой применения фибробластов в регенеративной медицине является их способность стимулировать процессы регенерации тканей, так как в организме они играют ключевую роль в заживлении раны. Данный биологический процесс представляет собой сложный каскад событий, включающий в себя несколько этапов – гемостаз, воспаление, пролиферацию и ремоделирование ткани. Миграция фибробластов в рану наблюдается уже спустя 24-48 часов после ее возникновения, поскольку в ране появляются хемоаттрактанты, привлекающие фибробласты (PDGF, интерлейкин-1, фактор некроза опухоли-α и т.д.). На этом этапе их основной задачей является разрушение фибринового сгустка. Разрушаемый сгусток замещается компонентами внеклеточного матрикса – коллагенами, гликопротеинами, гиалуроновой кислотой и т.д. Этот комплекс белков регулирует миграцию в поврежденный участок других фибробластов, запускающих сигнальные процессы, влияющие на ангиогенез, образование грануляционной ткани и эпителизацию. Снижение концентрации фибробластов в области повреждения при нормальном ранозаживлении наблюдается примерно через 14 дней, когда прочность внеклеточного матрикса в ране становится сопоставима с его прочностью в прилегающих тканях.
Дополнительной особенностью фибробластов, как и мезенхимных стромальных клеток является толерантность к ним иммунной системы. Это позволяет использовать аллогенный материал, избегая сложной процедуры подбора доноров.
1.1 Применение фибробластов в комбустиологии
Значительные успехи достигнуты при применении фибробластов при комплексном лечении термических поражений кожи у взрослых и детей. В России количество пациентов c термическими поражениями кожи, при лечении которых были использованы современные биотехнологические методы, превышает 5000. На сегодня в России это наиболее отработанная биотехнология, связанная с применением клеточного материала.
Интенсивное развитие биотехнологических методов связано с тем, что летальность среди пациентов с обширными глубокими ожогами в настоящий момент остается по-прежнему высокой даже в специализированных ожоговых стационарах. Это связано с тотальным дефицитом неповрежденных кожных покровов у больных с глубокими поражениями на площади более 30-40% поверхности тела. В таких случаях применение лишь традиционных методов пластического закрытия ран становится практически невозможным, а дополнительные раневые поверхности в местах забора аутодермотрансплантатов могут усугубить течение ожоговой болезни [4]. Впервые для временного закрытия глубоких ожоговых ран трупную аллокожу использовали в 1953 году [5]. Первое сообщение о возможности постоянного закрытия ожоговых ран трупной дермой появилось в 1985 году. Разработка методов культивирования фибробластов дермы и исследования их физиологии в ожоговой ране, проводимые в НМИЦ хирургии им. А.В. Вишневского начиная с 1985 года под руководством академика Д.С. Саркисова, привели к внедрению в 1993 г. в клиническую практику нового метода лечения термических поражений. Данный метод был основан на использовании культивированных дермальных фибробластов при обширных пограничных и глубоких ожогах [6]. Подобный метод используется сейчас в НМИЦ хирургии им. А.В. Вишневского (Москва), НИИ им. И.И. Джанелидзе (Санкт-Петербург), Приволжском федеральном медицинском исследовательском центре (Нижний Новгород). В настоящее время наиболее перспективным из предложенных методов считается использование культивированных фибробластов, ресуспендированных в гелевой среде на основе культуральной среды и метилцеллюлозы (НИИ им. А.И. Вишневского) или гидроксиэтилцеллюлозы (НИИ им. И.И. Джанелидзе) [4, 7]. Также используются т.н. «дермальные эквиваленты», разработанные в Институте цитологии РАН под руководством академика РАН Г.П. Пинаева – монослои фибробластов без специального носителя [8].
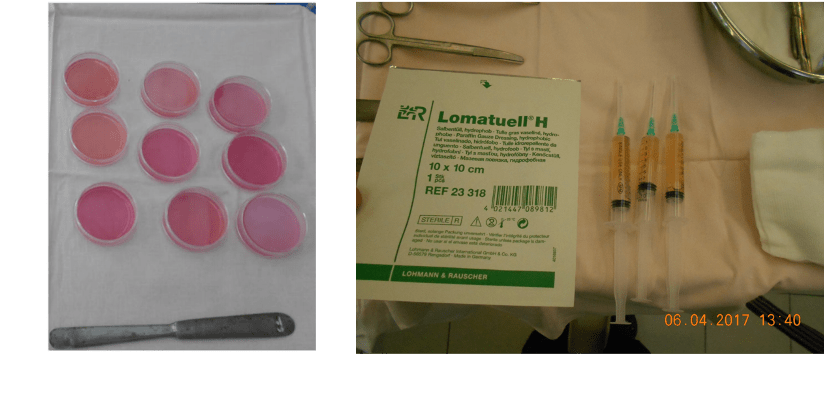
Центр клеточных технологий Покровского банка стволовых клеток принимает участие в разработке клеточносодержащих раневых покрытий на гелевой основе с 2009 года [9, 10, 11]. Разработанные нами покрытия с успехом применяются почти 10 лет в НИИ им. И.И. Джанелидзе. Результаты проводимого в 2015-2018 г. ограниченного клинического испытания в НИИ им. И.И. Джанелидзе опубликованы (Вагнер и др., 2018). Разработано методическое пособие по применению дермальных фибробластов в комбустиологии.
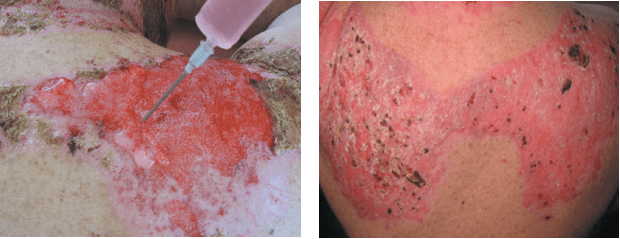
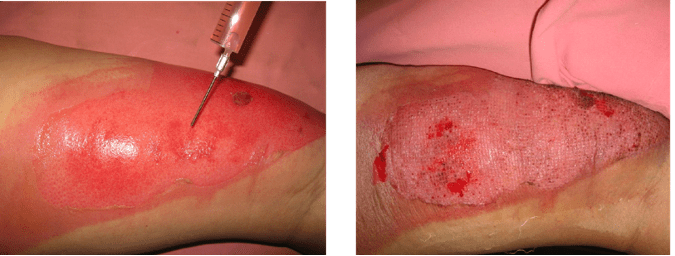

Как показывает опыт НМИЦ хирургии им. А.В. Вишневского (Москва) и наш собственный, наиболее высокие результаты достигаются при применении фибробластов, ресуспендированных в геле. Использование гелей в комбинации с мазевыми повязками Lomatuell позволяет сохранить препарат на поверхности раны и удлиняет срок жизни фибробластов в ране. При использовании гелей, содержащих аллогенные фибробласты достигается положительный эффект (сокращение сроков эпителизации) у 70 % пациентов с ожогами IIIа степени и 93 % пациентов с ожогами IIIб степени (Вагнер и др., 2018).
В настоящее время сотрудники ПБСК продолжают разработку биотехнологических раневых покрытий, как клеточносодержащих, так и бесклеточных.
Список литературы
- Зорина А.И. и др. Фибробласты дермы: особенности цитогенеза, цитофизиологии и возможности клинического применения.// Гены & Клетки. 2011. 6(2), с.: 15-26
- Бозо И.Я., Деев Р.В., Пинаев Г.П. «Фибробласт» – специализированная клетка или функциональное состояние клеток мезенхимного происхождения? //Цитология. 2010; 52(2): 99–109.
- Lynch MD, Watt FM. Fibroblast heterogeneity: implications for human disease. //J Clin Invest. 2018.128(1):26-35.
- Алексеев А.А., Пантелеев А.А., Мальцев В.И. Современные биотехнологические методы в комплексном лечении термических поражений// Высокотехнологичная медицина. 2019. 3: 22-33.
- Brown J, Fryer M, Randall P, Lu M. Postmortem Homografts as “Biological Dressings” for Extensive Burns and Denuded Areas.// Ann Surg. 1953;138(4):618-30.
- Sarkisov DS, Alekseev AA, Tumanov VP, Glushhenko EV, Morozov SS, Pal’cyn AA. Lechenie ozhogov s ispol’zovaniem kul’tivirovannyh kletok kozhi cheloveka.// Khirurgija. 1993;(3):22-7. (in Russ)
- Вагнер Д.О., Зиновьев Е.В., Крылов К.М., Крылов П.К., Солошенко В.В., Костяков Д.В., Юркевич Ю.В., Енукашвили Н.И., Блинова М.И., Александрова О.И., Михайлова Н.А.. Опыт клинического применения аллогенных фибробластов у пострадавших с обширными ожогами кожи.// Вестник Северо-Западного государственного медицин-ского университета им. И.И. Мечникова. 2018. 10(3). с. 65–72.
- Блинова М.И., Юдинцева Н.М., Александрова О.И., Баллюзек М.Ф., Хабарова И.Г., Маркин С.М., Чагунава О.Л. 2015. Клинический опыт заживления трофических язв с использованием клеточного продукта “Эквивалент дермальный ЭД”. Хирургические болезни. 4 (5): 690–695.
- Крылов, К.М., Смолянинов А.Б., Юркевич Ю.В. и др. Аллофибробласты в гелевой среде в лечении обожженных // Вопр. травматол. и ортопед. 2012. № 2 (3).с. 121-122.
- Смолянинов А.Б., Хрупина А.С., Юркевич Ю.В., Пирожков И.А., Супильникова О.В., Крылов К.М.,, Крылов П.К., Козулин И.Д. Использование полимера гидроксиэтилцеллюлозы в качестве носителя для аллогенных фибробластов при лечении последствий термических ожогов.// Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 2013. 5(4). с. 7-12.
- Юркевич Ю.В., Смолянинов А.Б., Хрупина А.С. Ранозаживляющее действие культивированных аллофибробластов в составе гелеобразующего носителя при лечении термических ожогов // Мат. Всерос.науч. — конф. с междунар. участием «Здоровье – основа человеческого потенциала: проблемы и пути их решения». — СПб.: СПбГУ, 2012. — С. 714 – 716.
1.2 Применение фибробластов в торакальной хирургии
Способность дермальных фибробластов стимулировать процессы регенерации в ране позволяет расширить спектр их применения.
В структуре торакальных операций пневмонэктомии занимают значительное место. Однако, несмотря на разработку современных шовных материалов, новых способов ушивания и пластики культи бронха, совершенствование хирургической техники, число бронхиальных осложнений после удаления легкого остается высоким. Из них наиболее грозными яв-ляются бронхиальные свищи, частота развития которых составляет 3–16% [1], а летальность достигает 20–75%.Существующие консервативные способы лечения пострезекционных бронхиальных свищей являются длительными и, зачастую, малоэффективными.
Сотрудниками центра клеточных технологий ПБСК совместно с врачами хирургического торакального отделения Покровской Больницы предложена технология эндобронхиальной окклюзии свища бронха с использованием суспензии культивированных аллогенных фибробластов человека. После эндобронхиального введения суспензии фибробластов просвет свищей не определялся в 6 наблюдениях из 10. Обтурация просвета бронха наступала через 7–9 суток после пересадки клеток. У остальных 4 больных свищевой ход сохранялся, что потребовало повторной клеточной инфильтрации. [2]. Таким образом, данная технология рассматривается в качестве перспективной, т.к. позволяет избежать повторного открытого хирургического вмешательства.
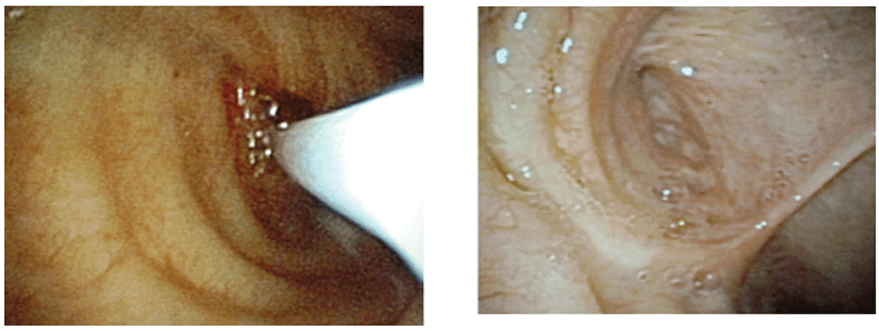
Список литературы:
- Порханов, В.А.Свищ главного бронха старая проблема в новых условиях [Текст] / В.А. Порханов // Материалы 2-й междунар. конф. по торакальной хирургии, посв. 40-летию профильных отделений РНЦХ РАМН. – М., 2003. – С. 212–223.
- Егоров В.И., Ионов П.М., Юркевич Ю.В., Смолянинов А.Б., Беседина Н.К.,.Акопов А.Л. Первый опыт применения клеточных технологий в торакальной хирургии.// Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 2015. 7(2): с. 7-13.
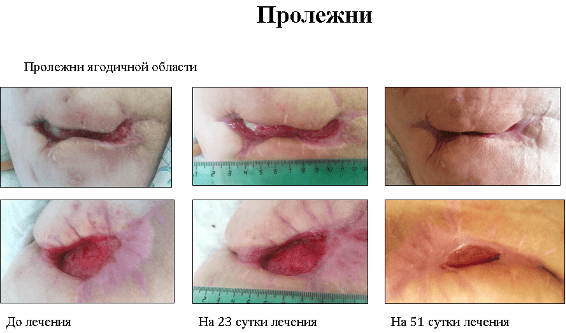
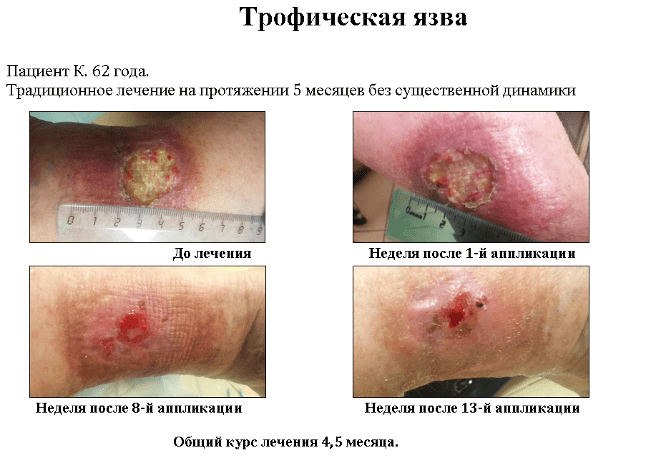
1.3 Применение фибробластов кожи при лечении трофических поражений кожи
1.4 Опухоль-ассоциированные фибробласты – основной компонент стромы опухоли
При разработке биотехнологических методов следует тщательно сопоставлять возможные риски с ожидаемой пользой от применения. Фибробласты человека (в отличие от фибробластов мыши) сами по себе не подвержены онкотрансформации. Однако, они играют важную роль в поддержании опухолевых клеток, формируя опухолевую строму, которая поддерживает пролиферацию опухолевых клеток, метастазирование, иммуносупрессию, стимулирует ангиогенез в опухоли., также в ряде случаев способствует развитию резистентности к противоопухолевым препаратам [1]. Опухоль-ассоциированные фибробласты – сравнительно гетерогенная популяция клеток, состоящая из субпопуляций, различных по своему профилю транскрипции [2]. Каждая из этих популяций выполняет определенные функции.
Возможно происхождение опухоль-ассоциированных фибробластов из различных клеток, в том числе и немезенхимного происхождения
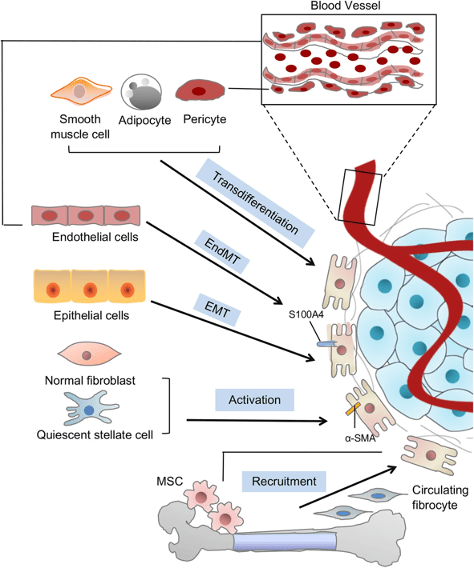
Первоначальная миграция нормальных фибробластов связана с тем, что растущая опухоль обладает некоторыми общими чертами с раной. Некоторые специалисты предлагают рассматривать опухоль как «незаживающую рану» [3]. Процессы, происходящие при росте опухоли привлекают фибробласты
Таким образом, хотя трансплантированные фибробласты сами не проходят процесс онкотрансформации, они теоретически могут стимулировать дальнейший рост и развитие еще не диагносцированной опухоли у пациента или стимулировать пролиферацию остаточных опухолевых клонов у онкологического пациента в стадии ремиссии. Следовательно при применении клеточных технологий, связанных с применением фибробластов необходимо тщательное обследование пациента и взвешивание баланса между ожидаемой пользой и возможными рисками, особенно у пациентов с опухолевыми заболеваниями (в том числе, в состоянии ремиссии).
Список литературы
- Sahai, E., Astsaturov, I., Cukierman, E. et al. A framework for advancing our understanding of cancer-associated fibroblasts.// Nat Rev Cancer 20, 174–186 (2020)
- Lambrechts, D., Wauters, E., Boeckx, B. et al. Phenotype molding of stromal cells in the lung tumor microenvironment.// Nat Med 24, 1277–1289 (2018).
- Foster DS, Jones RE, Ransom RC, Longaker MT, Norton JA. The evolving relationship of wound healing and tumor stroma. // JCI Insight. 2018;3(18):e99911. Published 2018 Sep 20. doi:10.1172/jci.insight.99911

